第63页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
7. 科学研究表明,氨气在常压下就可液化为液氨,液氨能在氧气中燃烧,发生反应的化学方程式为 aNH_3+bO_2$\frac{\underline{\;点燃\;}}{\;}$cN_2+dH_2O。下列叙述中,错误的是 ( )
A.氨气液化是物理变化
$B.NH_3 $中氮元素的化合价为+3
C.该反应的反应物和生成物都有一种单质和一种化合物
D.a、b、c、d 分别为 4、3、2、6
A.氨气液化是物理变化
$B.NH_3 $中氮元素的化合价为+3
C.该反应的反应物和生成物都有一种单质和一种化合物
D.a、b、c、d 分别为 4、3、2、6
答案:
B 解析:发生反应的化学方程式配平后如下:4NH₃+3O₂$\frac{\underline{点燃}}{}$2N₂+6H₂O。氨气液化只是状态的改变,无新物质生成,为物理变化,A正确;NH₃中氮元素的化合价为-3而非+3,B错误;该反应涉及的物质中,O₂、N₂为单质,NH₃、H₂O为化合物,C正确;根据配平结果可知,a、b、c、d分别为4、3、2、6,D正确。
8.(2025·德阳质检)碳酸镁是一种常见的非处方药,对胃肠黏膜有一定的保护作用,对胃病有一定的治疗作用,同时也是一种重要的工业原材料。利用镁矿资源将 CO_2 转化成碳酸镁是重要的生产途径,其工艺流程如图所示。
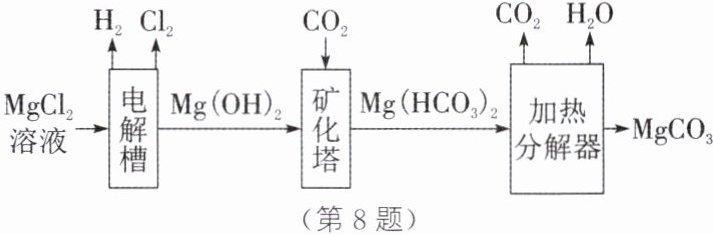
(1)电解槽中发生反应的化学方程式为 MgCl_2+2X$\frac{\underline{\;通电\;}}{\;}$H_2↑+Cl_2↑+Mg(OH)_2↓,则 X 的化学式是______。
(2)使用循环物质可有效节约生产成本,本流程可以循环使用的物质有______(不考虑水)。
(3)加热分解器中发生反应的化学方程式为______。

(1)电解槽中发生反应的化学方程式为 MgCl_2+2X$\frac{\underline{\;通电\;}}{\;}$H_2↑+Cl_2↑+Mg(OH)_2↓,则 X 的化学式是______。
(2)使用循环物质可有效节约生产成本,本流程可以循环使用的物质有______(不考虑水)。
(3)加热分解器中发生反应的化学方程式为______。
答案:
(1)H₂O (2)CO₂ (3)Mg(HCO₃)₂$\xlongequal{\triangle}$MgCO₃+H₂O+CO₂↑ 解析:(1)根据反应的化学方程式MgCl₂+2X$\frac{\underline{通电}}{}$H₂↑+Cl₂↑+Mg(OH)₂↓可知,生成物中氢原子、氯原子、镁原子、氧原子的数目分别为4、2、1、2,反应物的已知物中氢原子、氯原子、镁原子、氧原子的数目分别为0、2、1、0,由质量守恒定律可知,化学反应前后原子的种类和数目保持不变,则2X中含有4个氢原子和2个氧原子,X的化学式为H₂O。(2)根据流程图可知,二氧化碳在工艺流程中既是一个反应的反应物,又是另一个反应的生成物,可循环使用。(3)加热分解器中的反应物是碳酸氢镁,生成物是二氧化碳、水和碳酸镁,化学方程式为Mg(HCO₃)₂$\xlongequal{\triangle}$MgCO₃+H₂O+CO₂↑。
9. 新型材料纳米级 α-Fe 具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等。实验室采用气相还原法制备纳米级 α-Fe,方法是将固体粉料$ FeCl_2·nH_2O $脱水、真空干燥,然后在高温条件下通入高纯氮气(作保护气)和氢气(作还原剂)的混合气体,生成纳米级 α-Fe。请回答下列问题。
(1)写出生成纳米级 α-Fe 的化学方程式:
①______。
②______。
(2)反应中保护气的作用是______。
(1)写出生成纳米级 α-Fe 的化学方程式:
①______。
②______。
(2)反应中保护气的作用是______。
答案:
(1)①FeCl₂·nH₂O$\xlongequal{\quad}$FeCl₂+nH₂O ②FeCl₂+H₂$\frac{\underline{N₂}}{高温}$Fe+2HCl (2)防止生成的α-Fe在高温下与氧气反应
10. 汽车行业的飞速发展将带来环境与能源的双重危机。
(1)汽车玻璃水的主要成分是甲醇(CH_3OH),其与乙醇(C_2H_5OH)一样具有可燃性。
①写出甲醇(CH_3OH)完全燃烧生成二氧化碳和水的化学方程式:______。
②若要检验甲醇的燃烧产物,除用到火柴、酒精灯、干燥的烧杯外,还应补充的一种试剂为______。
(2)汽车排放的尾气中含有 SO_2、CO、NO、悬浮颗粒等污染物,有如下的治理方法:
①在汽车的排气管上安装催化转换器,让 CO 与 NO 反应,生成两种大气中的无毒气体。反应的化学方程式为______。
②以压缩天然气(主要成分是 CH_4)作汽车燃料,其完全燃烧生成二氧化碳和水的化学方程式为______。
(3)自然界消耗 CO_2 的主要途径有光合作用和海水吸收,绿色植物的光合作用吸收二氧化碳可表示为 6CO_2+6H_2O$\frac{\underline{\;一定条件\;}}{\;}$C_6H_1_2O_6+6X,则 X 的化学式为______。
(4)将 CO_2 转化为化工原料乙烯(C_2H_4),其反应的微观示意图如图所示。
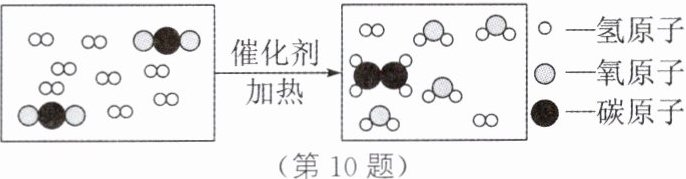
参加反应的二氧化碳与氢气的分子个数比为______(填最简整数比)。
(1)汽车玻璃水的主要成分是甲醇(CH_3OH),其与乙醇(C_2H_5OH)一样具有可燃性。
①写出甲醇(CH_3OH)完全燃烧生成二氧化碳和水的化学方程式:______。
②若要检验甲醇的燃烧产物,除用到火柴、酒精灯、干燥的烧杯外,还应补充的一种试剂为______。
(2)汽车排放的尾气中含有 SO_2、CO、NO、悬浮颗粒等污染物,有如下的治理方法:
①在汽车的排气管上安装催化转换器,让 CO 与 NO 反应,生成两种大气中的无毒气体。反应的化学方程式为______。
②以压缩天然气(主要成分是 CH_4)作汽车燃料,其完全燃烧生成二氧化碳和水的化学方程式为______。
(3)自然界消耗 CO_2 的主要途径有光合作用和海水吸收,绿色植物的光合作用吸收二氧化碳可表示为 6CO_2+6H_2O$\frac{\underline{\;一定条件\;}}{\;}$C_6H_1_2O_6+6X,则 X 的化学式为______。
(4)将 CO_2 转化为化工原料乙烯(C_2H_4),其反应的微观示意图如图所示。

参加反应的二氧化碳与氢气的分子个数比为______(填最简整数比)。
答案:
(1)①2CH₃OH+3O₂$\frac{\underline{点燃}}{}$2CO₂+4H₂O ②澄清石灰水 (2)①2CO+2NO$\frac{\underline{催化剂}}{}$N₂+2CO₂ ②CH₄+2O₂$\frac{\underline{点燃}}{}$CO₂+2H₂O (3)O₂ (4)1:3 解析:(1)①甲醇完全燃烧生成二氧化碳和水。②二氧化碳一般用澄清石灰水检验。(2)①CO与NO在催化剂的作用下反应,生成两种大气中的无毒气体,根据元素种类及空气中的成分可知,这两种气体是二氧化碳和氮气。②压缩天然气的主要成分是甲烷(CH₄),其完全燃烧生成水和二氧化碳。(3)根据化学反应前后原子的种类和数目不变,反应前反应物中有6个碳原子、12个氢原子、18个氧原子,反应后已知生成物中有6个碳原子、12个氢原子、6个氧原子,说明6X中含有12个氧原子,则1个X分子中含有2个氧原子,故X的化学式为O₂。(4)根据微观示意图,CO₂和H₂在催化剂和加热的条件下反应生成乙烯(C₂H₄)和水,化学方程式为2CO₂+6H₂$\frac{\underline{催化剂}}{\triangle}$C₂H₄+4H₂O,由化学方程式可知,参加反应的二氧化碳与氢气的分子个数比为2:6=1:3。
查看更多完整答案,请扫码查看


