第83页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
5. 空气中$CO_2$的含量超过0.05%时就会加剧温室效应,所以人们一方面想限制其排放量,另一方面又想对它进行再利用。
(1)目前,有人用超临界(一种介于气态和液态之间的状态$)CO_2$作制冷剂(以前用氟利昂),这种做法对环境的积极意义在于______。
(2)科学家提出回收$CO_2$的构想:把空气吹入碳酸钾溶液,从溶液中提取出$CO_2,$又在合成塔中使之变为燃料——甲醇$(CH_3OH)。$该技术流程如图所示。(已知:a. 吸收池中盛有足量$K_2CO_3$溶液,合成塔内的反应条件为300℃、200kPa和催化剂。b. 空气中$CO_2$的含量太低时,不利于反应向生成甲醇的方向进行。)
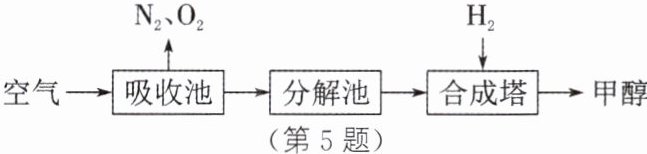
① 合成塔中发生反应的化学方程式为______。
② 如果空气不经过吸收池和分解池,而是直接通入合成塔,你认为可行吗?______,请简述理由:______。
③ 若生产6.4 t甲醇,则可回收______t空气中的$CO_2。$
(1)目前,有人用超临界(一种介于气态和液态之间的状态$)CO_2$作制冷剂(以前用氟利昂),这种做法对环境的积极意义在于______。
(2)科学家提出回收$CO_2$的构想:把空气吹入碳酸钾溶液,从溶液中提取出$CO_2,$又在合成塔中使之变为燃料——甲醇$(CH_3OH)。$该技术流程如图所示。(已知:a. 吸收池中盛有足量$K_2CO_3$溶液,合成塔内的反应条件为300℃、200kPa和催化剂。b. 空气中$CO_2$的含量太低时,不利于反应向生成甲醇的方向进行。)

① 合成塔中发生反应的化学方程式为______。
② 如果空气不经过吸收池和分解池,而是直接通入合成塔,你认为可行吗?______,请简述理由:______。
③ 若生产6.4 t甲醇,则可回收______t空气中的$CO_2。$
答案:
(1)保护臭氧层 (2)①${CO2 +3H2 \xlongequal[300℃、200\ kPa]{催化剂} CH3OH +H2O}$ ②不可行 空气中CO₂的含量太低,不利于反应向生成甲醇的方向进行 ③8.8 解析:
(1)氟利昂会破坏臭氧层,造成臭氧层空洞,故用二氧化碳代替氟利昂能保护臭氧层。
(2)②根据题意,空气中CO₂的含量太低时,不利于反应向生成甲醇的方向进行,故通过吸收池和分解池就是为了增大二氧化碳的浓度,再通入合成塔。③设可回收空气中的CO₂的质量为x。${CO2 +3H2 \xlongequal[300℃、200\ kPa]{催化剂} CH3OH +H2O}$44 32x 6.4 t$\frac{44}{32}=\frac{x}{6.4\ t}$ $x=8.8\ t$若生产6.4 t甲醇,则可回收8.8 t空气中的CO₂。
(1)氟利昂会破坏臭氧层,造成臭氧层空洞,故用二氧化碳代替氟利昂能保护臭氧层。
(2)②根据题意,空气中CO₂的含量太低时,不利于反应向生成甲醇的方向进行,故通过吸收池和分解池就是为了增大二氧化碳的浓度,再通入合成塔。③设可回收空气中的CO₂的质量为x。${CO2 +3H2 \xlongequal[300℃、200\ kPa]{催化剂} CH3OH +H2O}$44 32x 6.4 t$\frac{44}{32}=\frac{x}{6.4\ t}$ $x=8.8\ t$若生产6.4 t甲醇,则可回收8.8 t空气中的CO₂。
6. 二氧化碳的捕集和资源化利用是“碳中和”领域的研究热点。
Ⅰ. 碳捕集:捕捉烟气中的$CO_2,$再将其释放出可实现资源化利用,相关物质转化如图甲所示。
查阅资料:
A. 氢氧化钠与氢氧化钙的化学性质相似。
$B. Ca(OH)_2+Na_2CO_3= CaCO_3↓+2NaOH。$
$C. CaO+H_2O= Ca(OH)_2。$
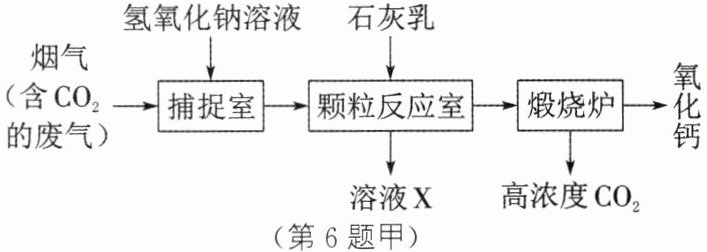
(1)“捕捉室”中发生反应的化学方程式为______。
(2)上述流程中,可循环使用的物质有______(填化学式)。
Ⅱ. 碳的资源化利用:我国科学家已实现由$CO_2$到淀粉的人工全合成,主要过程如图乙所示:
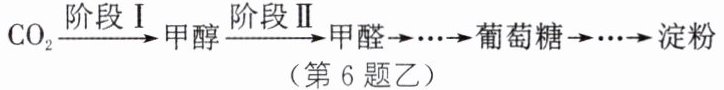
(3)绿色植物实现$CO_2$到葡萄糖的转化过程称为______。
(4)阶段Ⅱ的物质转化如图丙所示。反应a中四种物质的化学计量数均为1。

① 推测分子中氢原子数目:甲醇______(填“>”“<”或“=”)甲醛。
② 为了使甲醇能够持续转化为甲醛,反应b需要补充$H_2O_2,$则理论上需要补充的$H_2O_2$与反应a中生成的$H_2O_2$的分子个数比N(需要补充的$H_2O_2)/N($反应a中生成的$H_2O_2)≥______。$
Ⅰ. 碳捕集:捕捉烟气中的$CO_2,$再将其释放出可实现资源化利用,相关物质转化如图甲所示。
查阅资料:
A. 氢氧化钠与氢氧化钙的化学性质相似。
$B. Ca(OH)_2+Na_2CO_3= CaCO_3↓+2NaOH。$
$C. CaO+H_2O= Ca(OH)_2。$

(1)“捕捉室”中发生反应的化学方程式为______。
(2)上述流程中,可循环使用的物质有______(填化学式)。
Ⅱ. 碳的资源化利用:我国科学家已实现由$CO_2$到淀粉的人工全合成,主要过程如图乙所示:

(3)绿色植物实现$CO_2$到葡萄糖的转化过程称为______。
(4)阶段Ⅱ的物质转化如图丙所示。反应a中四种物质的化学计量数均为1。

① 推测分子中氢原子数目:甲醇______(填“>”“<”或“=”)甲醛。
② 为了使甲醇能够持续转化为甲醛,反应b需要补充$H_2O_2,$则理论上需要补充的$H_2O_2$与反应a中生成的$H_2O_2$的分子个数比N(需要补充的$H_2O_2)/N($反应a中生成的$H_2O_2)≥______。$
答案:
(1)CO₂+2NaOH=Na₂CO₃+H₂O (2)NaOH、CaO[或NaOH、Ca(OH)₂] (3)光合作用 (4)①> ②1 解析:
(1)由题图甲中信息可知,“捕捉室”中发生反应的化学方程式为CO₂+2NaOH=Na₂CO₃+H₂O,Na₂CO₃进入“颗粒反应室”中与加入的Ca(OH)₂反应生成CaCO₃沉淀和NaOH。(2)分析题图甲可知,“颗粒反应室”中生成的NaOH可以重新加入“捕捉室”中,“煅烧炉”中生成的CaO和水反应生成的Ca(OH)₂可以重新加入“颗粒反应室”中,故它们都可以循环使用。(3)绿色植物通过光合作用把CO₂转化为葡萄糖。(4)①根据反应a中四种物质的化学计量数均为1,可知反应前只有甲醇分子中含有氢原子,而反应后过氧化氢分子中也含有氢原子,由反应前后原子的个数不变可知,甲醇分子中的氢原子数目比甲醛分子中的多。②过氧化氢分解时,过氧化氢与生成氧气的分子个数关系为2H₂O₂~O₂,由反应a中四种物质的化学计量数均为1可知,反应a中氧气与生成过氧化氢的分子个数关系为O₂~H₂O₂,为了使甲醇能够持续转化为甲醛,则理论上需要补充的过氧化氢的分子个数应大于或等于反应a中生成的过氧化氢的分子个数,即$\frac{N(需要补充的\ H_2O_2)}{N(反应a中生成的\ H_2O_2)}\geq1$。
(1)由题图甲中信息可知,“捕捉室”中发生反应的化学方程式为CO₂+2NaOH=Na₂CO₃+H₂O,Na₂CO₃进入“颗粒反应室”中与加入的Ca(OH)₂反应生成CaCO₃沉淀和NaOH。(2)分析题图甲可知,“颗粒反应室”中生成的NaOH可以重新加入“捕捉室”中,“煅烧炉”中生成的CaO和水反应生成的Ca(OH)₂可以重新加入“颗粒反应室”中,故它们都可以循环使用。(3)绿色植物通过光合作用把CO₂转化为葡萄糖。(4)①根据反应a中四种物质的化学计量数均为1,可知反应前只有甲醇分子中含有氢原子,而反应后过氧化氢分子中也含有氢原子,由反应前后原子的个数不变可知,甲醇分子中的氢原子数目比甲醛分子中的多。②过氧化氢分解时,过氧化氢与生成氧气的分子个数关系为2H₂O₂~O₂,由反应a中四种物质的化学计量数均为1可知,反应a中氧气与生成过氧化氢的分子个数关系为O₂~H₂O₂,为了使甲醇能够持续转化为甲醛,则理论上需要补充的过氧化氢的分子个数应大于或等于反应a中生成的过氧化氢的分子个数,即$\frac{N(需要补充的\ H_2O_2)}{N(反应a中生成的\ H_2O_2)}\geq1$。
查看更多完整答案,请扫码查看


