第55页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
1.[数字化实验](2024·新疆)用数字传感器探究稀盐酸与稀氢氧化钠溶液反应过程中温度和pH的变化,测定结果如图所示。下列说法正确的是 ( )
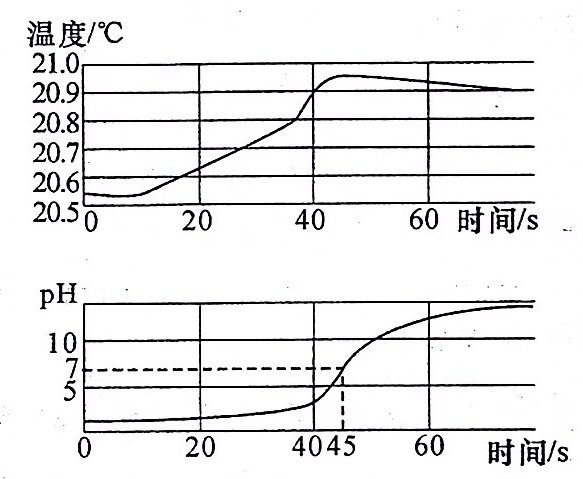
A. 该反应为吸热反应
B. 反应过程中,溶液的酸性逐渐增强
C. 该实验是向稀氢氧化钠溶液中加入稀盐酸
D. 45 s时,稀盐酸与稀氢氧化钠溶液恰好完全反应

A. 该反应为吸热反应
B. 反应过程中,溶液的酸性逐渐增强
C. 该实验是向稀氢氧化钠溶液中加入稀盐酸
D. 45 s时,稀盐酸与稀氢氧化钠溶液恰好完全反应
答案:
D
2.[化学观念](2023·宜宾)以宏观、微观、符号相结合的方式认识和表示化学变化是学习化学的重要思维方式。某实验小组同学探究酸碱中和反应,向滴有酚酞的稀NaOH溶液中加入稀盐酸,发生反应的微观过程如图。

(1)滴有酚酞的稀NaOH溶液呈______色。
(2)反应结束时,溶液的pH ______(填“>”“<”或“=”)7。
(3)由图可知,NaOH溶液与盐酸反应的实质是______。

(1)滴有酚酞的稀NaOH溶液呈______色。
(2)反应结束时,溶液的pH ______(填“>”“<”或“=”)7。
(3)由图可知,NaOH溶液与盐酸反应的实质是______。
答案:
(1)红
(2)<
(3)氢离子与氢氧根离子结合生成水分子
(1)红
(2)<
(3)氢离子与氢氧根离子结合生成水分子
3.某同学利用图1装置研究稀硫酸与氢氧化钠溶液发生中和反应的过程,并用pH和温度传感器测量反应过程中相关物理量的变化情况,得到图2和图3。
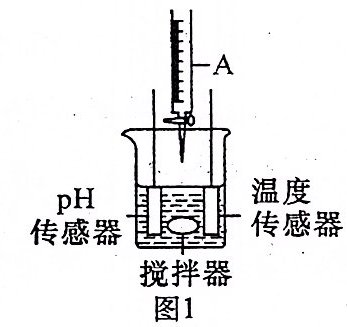
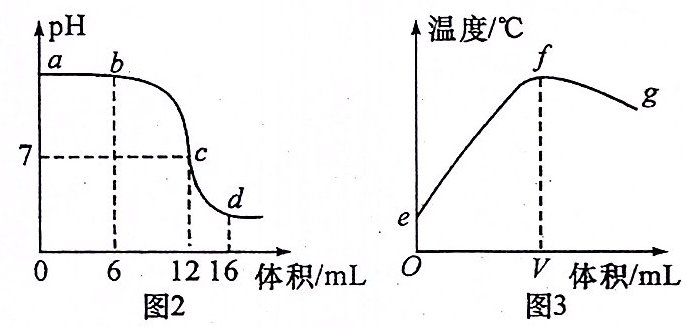
(1)图1仪器A中的溶液是______(填“稀硫酸”或“氢氧化钠溶液”)。
(2)图2中b处溶液的溶质是______(填化学式);该处溶液加入紫色石蕊溶液,溶液呈______色。
(3)图3中V的数值最接近______(填“6”“12”或“16”)。
(4)向图2中d处溶液中加入少量氧化铁粉末,现象为______。


(1)图1仪器A中的溶液是______(填“稀硫酸”或“氢氧化钠溶液”)。
(2)图2中b处溶液的溶质是______(填化学式);该处溶液加入紫色石蕊溶液,溶液呈______色。
(3)图3中V的数值最接近______(填“6”“12”或“16”)。
(4)向图2中d处溶液中加入少量氧化铁粉末,现象为______。
答案:
(1)稀硫酸
(2)$\mathrm{Na}_{2}\mathrm{SO}_{4}$、$\mathrm{NaOH}$ 蓝
(3)12
(4)红色粉末溶解,无色溶液变为黄色
(1)稀硫酸
(2)$\mathrm{Na}_{2}\mathrm{SO}_{4}$、$\mathrm{NaOH}$ 蓝
(3)12
(4)红色粉末溶解,无色溶液变为黄色
4.[项目式学习]中和反应在工农业生产和日常生活中有广泛的用途。某化学兴趣小组以“中和反应”为课题进行项目式学习,请你一起参与。
任务一 中和反应的应用
(1)《天工开物》中记载“石灰淹苗足”,利用了中和反应的原理,如果土壤呈酸性是因为有硝酸,写出氢氧化钙与其反应的化学方程式:______。下列应用原理与其不同的是______(填字母)。
A. 服用含Al(OH)₃的药物治疗胃酸过多
B. 用熟石灰处理硫酸厂的酸性废水
C. 用稀盐酸除去钢铁表面的铁锈
D. 用稀氨水处理蚊虫叮咬处(含蚁酸)
任务二 探究酸和碱之间能否反应
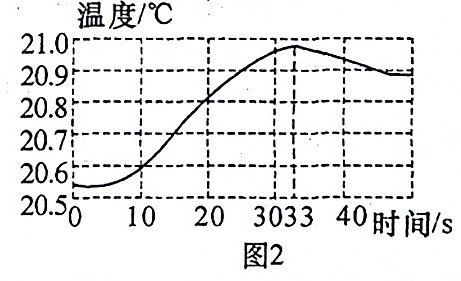
通过pH传感器和温度传感器完成以下实验:向40 mL质量分数为0.4%的氢氧化钠溶液中逐滴滴入稀盐酸,测定溶液的pH随滴入稀盐酸体积的变化情况如图1所示。利用温度传感器测得反应过程中溶液温度随时间变化的曲线如图2所示。
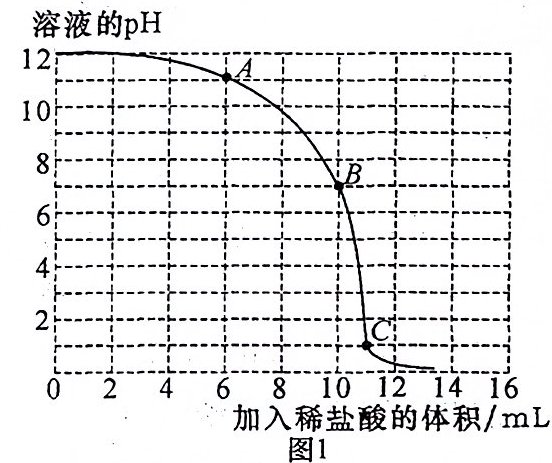
(2)如图1,向A点对应溶液中滴加无色酚酞溶液,溶液呈______色。
(3)如图2,当33 s≤t≤40 s时,对应溶液中所含溶质的成分为______(写化学式)。
(4)由图1得出酸和碱之间发生了反应的依据是______。
任务三 反思拓展
(5)有同学提出质疑,溶液温度升高,还可能是因为______。请你设计实验证明中和反应是放热反应,实验方案是______。
任务一 中和反应的应用
(1)《天工开物》中记载“石灰淹苗足”,利用了中和反应的原理,如果土壤呈酸性是因为有硝酸,写出氢氧化钙与其反应的化学方程式:______。下列应用原理与其不同的是______(填字母)。
A. 服用含Al(OH)₃的药物治疗胃酸过多
B. 用熟石灰处理硫酸厂的酸性废水
C. 用稀盐酸除去钢铁表面的铁锈
D. 用稀氨水处理蚊虫叮咬处(含蚁酸)
任务二 探究酸和碱之间能否反应
通过pH传感器和温度传感器完成以下实验:向40 mL质量分数为0.4%的氢氧化钠溶液中逐滴滴入稀盐酸,测定溶液的pH随滴入稀盐酸体积的变化情况如图1所示。利用温度传感器测得反应过程中溶液温度随时间变化的曲线如图2所示。


(2)如图1,向A点对应溶液中滴加无色酚酞溶液,溶液呈______色。
(3)如图2,当33 s≤t≤40 s时,对应溶液中所含溶质的成分为______(写化学式)。
(4)由图1得出酸和碱之间发生了反应的依据是______。
任务三 反思拓展
(5)有同学提出质疑,溶液温度升高,还可能是因为______。请你设计实验证明中和反应是放热反应,实验方案是______。
答案:
(1)$2\mathrm{HNO}_{3}+\mathrm{Ca}(\mathrm{OH})_{2}=\mathrm{Ca}(\mathrm{NO}_{3})_{2}+2\mathrm{H}_{2}\mathrm{O}$ C
(2)红
(3)$\mathrm{NaCl}$、$\mathrm{HCl}$
(4)溶液的pH逐渐减小至小于7
(5)氢氧化钠溶液稀释放热 将盐酸换成等体积的水做对比实验,若稀释放出的热比上述少,证明中和反应放热
(1)$2\mathrm{HNO}_{3}+\mathrm{Ca}(\mathrm{OH})_{2}=\mathrm{Ca}(\mathrm{NO}_{3})_{2}+2\mathrm{H}_{2}\mathrm{O}$ C
(2)红
(3)$\mathrm{NaCl}$、$\mathrm{HCl}$
(4)溶液的pH逐渐减小至小于7
(5)氢氧化钠溶液稀释放热 将盐酸换成等体积的水做对比实验,若稀释放出的热比上述少,证明中和反应放热
查看更多完整答案,请扫码查看


