2026年金考卷中考45套汇编化学河北专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年金考卷中考45套汇编化学河北专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第59页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
14. (6分)CO₂的转化利用是实现碳中和的重要途径。如图是CO₂与某种单质反应生成甲醇(CH₃OH)的微观示意图。

请回答下列问题:
(1)乙的化学式为
(2)丙物质中碳、氢元素的质量比为
(3)该反应的化学方程式为
(4)若反应得到了64g丙,则消耗了
(5)为实现碳中和,请你写一条建议:

请回答下列问题:
(1)乙的化学式为
H₂
,判断的依据为化学反应前后元素(或原子)的种类不变
。(2)丙物质中碳、氢元素的质量比为
3:1
。(填最简整数比)(3)该反应的化学方程式为
CO₂ + 3H₂ 一定条件 CH₃OH + H₂O
。(4)若反应得到了64g丙,则消耗了
88
g二氧化碳。(5)为实现碳中和,请你写一条建议:
减少私家车出行(合理即可)
。
答案:
14
(1)H₂ 化学反应前后元素(或原子)的种类不变
(2)3:1
(3)CO₂ + 3H₂ 一定条件 CH₃OH + H₂O
(4)88
(5)减少私家车出行(合理即可)
【解题思路】
(1)由微观示意图可知,已知反应物中含C、O元素,生成物中含C、H、O元素,根据化学反应前后元素(或原子)种类不变,反应物中还应含H元素,又因为乙是单质,所以乙是氢气,化学式为H₂。
(2)丙是CH₃OH,其中碳、氢元素的质量比为12:4 = 3:1。
(4)根据化学方程式可知,消耗二氧化碳与生成甲醇的质量比为44:32,所以若反应得到了64 g甲醇,则消耗二氧化碳的质量为88 g。
(1)H₂ 化学反应前后元素(或原子)的种类不变
(2)3:1
(3)CO₂ + 3H₂ 一定条件 CH₃OH + H₂O
(4)88
(5)减少私家车出行(合理即可)
【解题思路】
(1)由微观示意图可知,已知反应物中含C、O元素,生成物中含C、H、O元素,根据化学反应前后元素(或原子)种类不变,反应物中还应含H元素,又因为乙是单质,所以乙是氢气,化学式为H₂。
(2)丙是CH₃OH,其中碳、氢元素的质量比为12:4 = 3:1。
(4)根据化学方程式可知,消耗二氧化碳与生成甲醇的质量比为44:32,所以若反应得到了64 g甲醇,则消耗二氧化碳的质量为88 g。
15. (5分)铁丝的灵活性使其成为家居制作的理想材料,如衣架、挂钩、篮子及置物架等。下图为铁丝生产的工艺流程图,请根据流程图回答以下问题。
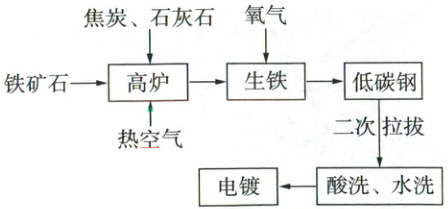
(1)装入高炉之前,将铁矿石粉碎的目的是
(2)高炉内,铁矿石(主要成分是Fe₂O₃)在高温条件下会被还原,其反应的化学方程式为
(3)拉拔的目的是使铁变成铁丝,可知铁具有
(4)酸洗是为了洗去铁丝表面的氧化膜,但要控制酸洗时间,这是因为
(5)一般在铁丝表面镀一层锌,电镀的目的是

(1)装入高炉之前,将铁矿石粉碎的目的是
增大反应物间的接触面积,使反应更快、更充分
。(2)高炉内,铁矿石(主要成分是Fe₂O₃)在高温条件下会被还原,其反应的化学方程式为
3CO + Fe₂O₃ 高温 2Fe + 3CO₂
。(3)拉拔的目的是使铁变成铁丝,可知铁具有
延展
性。(4)酸洗是为了洗去铁丝表面的氧化膜,但要控制酸洗时间,这是因为
酸会与铁继续反应(合理即可)
。(5)一般在铁丝表面镀一层锌,电镀的目的是
防止铁生锈
。
答案:
15
(1)增大反应物间的接触面积,使反应更快、更充分
(2)3CO + Fe₂O₃ 高温 2Fe + 3CO₂
(3)延展
(4)酸会与铁继续反应(合理即可)
(5)防止铁生锈
(1)增大反应物间的接触面积,使反应更快、更充分
(2)3CO + Fe₂O₃ 高温 2Fe + 3CO₂
(3)延展
(4)酸会与铁继续反应(合理即可)
(5)防止铁生锈
16. (5分)根据图中装置进行实验,回答下列问题。
(1)小明用燃着的蜡烛探究燃烧和灭火。如图1,将燃着的蜡烛放在烧杯内,向烧杯内加入过氧化氢溶液和二氧化锰,发现蜡烛的火焰燃烧得更旺。其原因是
(2)如图3为电解水实验。
任务一:探究水的组成。
证明水中含有氧元素的实验操作是将
完成相应实验可得结论:水由氢、氧元素组成。电解水的化学方程式为:
任务二:探究物质对电解水产生氢气速率的影响。
分别取等质量12%的碳酸钠、硫酸钠、氢氧化钠溶液,在相同条件下进行实验,产生氢气的速率如图4所示。由此可知,在相同条件下,加入
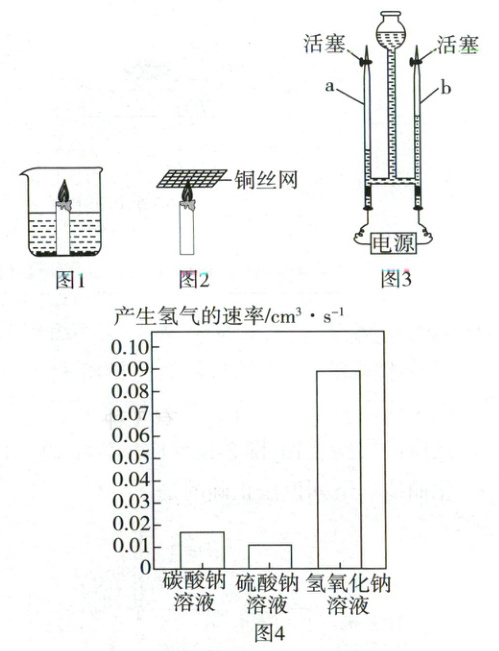
(1)小明用燃着的蜡烛探究燃烧和灭火。如图1,将燃着的蜡烛放在烧杯内,向烧杯内加入过氧化氢溶液和二氧化锰,发现蜡烛的火焰燃烧得更旺。其原因是
过氧化氢与二氧化锰混合产生了氧气,为燃烧提供了充足的氧气(合理即可)
。取出蜡烛,将铜丝网放置在蜡烛火焰中上部,发现铜丝网上方没有火焰,如图2所示。请分析铜丝网上方没有火焰的原因是铜丝导热,使温度降低到可燃物的着火点以下
。(2)如图3为电解水实验。
任务一:探究水的组成。
证明水中含有氧元素的实验操作是将
带有火星的木条(或燃着的木条)放在b管
口处,打开活塞,观察现象。完成相应实验可得结论:水由氢、氧元素组成。电解水的化学方程式为:
2H₂O 通电 2H₂↑ + O₂↑
。任务二:探究物质对电解水产生氢气速率的影响。
分别取等质量12%的碳酸钠、硫酸钠、氢氧化钠溶液,在相同条件下进行实验,产生氢气的速率如图4所示。由此可知,在相同条件下,加入
NaOH溶液
,产生氢气的速率最大。
答案:
16
(1)过氧化氢与二氧化锰混合产生了氧气,为燃烧提供了充足的氧气(合理即可) 铜丝导热,使温度降低到可燃物的着火点以下
(2)带有火星的木条(或燃着的木条)放在b管 2H₂O 通电 2H₂↑ + O₂↑ NaOH溶液
名师碎碎念 电解水时“正氧负氢、氢二氧一”。
(1)过氧化氢与二氧化锰混合产生了氧气,为燃烧提供了充足的氧气(合理即可) 铜丝导热,使温度降低到可燃物的着火点以下
(2)带有火星的木条(或燃着的木条)放在b管 2H₂O 通电 2H₂↑ + O₂↑ NaOH溶液
名师碎碎念 电解水时“正氧负氢、氢二氧一”。
查看更多完整答案,请扫码查看


