2026年金考卷中考45套汇编化学河北专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年金考卷中考45套汇编化学河北专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第55页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
14. (5分)光催化固氮是一种简单、灵活的合成氨技术,该反应的微观过程如图所示。

请回答下列问题:
(1)甲、乙、丙、丁四种物质中,
(2)该反应中参加反应的乙和生成的丁分子个数比为
(3)该反应的基本反应类型是
(4)该反应前后一定不变的是
A. 催化剂的质量
B. 单个原子的质量
C. 氮气的质量
D. 物质的总质量
(5)当前,氨气的能源化应用有着广阔的前景,其中之一是将氨气与氧气反应生成氮气和水并放出能量。将该反应和如图反应对比分析,你的收获是

请回答下列问题:
(1)甲、乙、丙、丁四种物质中,
丙
能使带有火星的木条复燃。(2)该反应中参加反应的乙和生成的丁分子个数比为
3:2
。(3)该反应的基本反应类型是
置换反应
。(4)该反应前后一定不变的是
ABD
(填字母)。A. 催化剂的质量
B. 单个原子的质量
C. 氮气的质量
D. 物质的总质量
(5)当前,氨气的能源化应用有着广阔的前景,其中之一是将氨气与氧气反应生成氮气和水并放出能量。将该反应和如图反应对比分析,你的收获是
化学反应不仅是物质的转化过程,也伴随着能量的转化与储存(合理即可)
(写一条即可)。
答案:
14
(1)丙
(2)3:2
(3)置换反应
(4)ABD
(5)化学反应不仅是物质的转化过程,也伴随着能量的转化与储存(合理即可)
【解题思路】甲是N₂,乙是H₂O,丙是O₂,丁是NH₃,该反应的化学方程式是2N₂+6H₂O 光 催化剂 3O₂+4NH₃。
(3)该反应符合置换反应“单换单”的特征,属于置换反应。
(4)根据质量守恒定律,化学反应前后物质的总质量不变,各原子质量不变;催化剂的质量和化学性质在反应前后不发生改变。
(1)丙
(2)3:2
(3)置换反应
(4)ABD
(5)化学反应不仅是物质的转化过程,也伴随着能量的转化与储存(合理即可)
【解题思路】甲是N₂,乙是H₂O,丙是O₂,丁是NH₃,该反应的化学方程式是2N₂+6H₂O 光 催化剂 3O₂+4NH₃。
(3)该反应符合置换反应“单换单”的特征,属于置换反应。
(4)根据质量守恒定律,化学反应前后物质的总质量不变,各原子质量不变;催化剂的质量和化学性质在反应前后不发生改变。
15. (5分)一包固体粉末中可能含有碳酸钙、硫酸铜、氯化钠、锌粉中的两种或多种。化学小组取少量固体粉末样品进行了如图所示的实验,最终确定了固体粉末中一定含有碳酸钙、硫酸铜和锌粉。
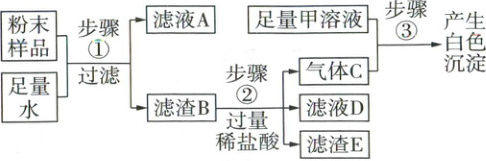
请回答下列问题:
(1)甲溶液可能是
(2)上述流程中能证明固体粉末中一定含有硫酸铜的证据是
(3)步骤①中发生的反应的化学方程式为
(4)气体C和滤渣E中一定属于纯净物的是

请回答下列问题:
(1)甲溶液可能是
氢氧化钙溶液(或氢氧化钡溶液)
,步骤③可以证明待测粉末中一定含有碳酸钙
。(2)上述流程中能证明固体粉末中一定含有硫酸铜的证据是
步骤②加入过量稀盐酸得到滤渣E
。(3)步骤①中发生的反应的化学方程式为
Zn+CuSO₄=ZnSO₄+Cu
。(4)气体C和滤渣E中一定属于纯净物的是
滤渣E
。
答案:
15
(1)氢氧化钙溶液(或氢氧化钡溶液) 碳酸钙
(2)步骤②加入过量稀盐酸得到滤渣E
(3)Zn+CuSO₄=ZnSO₄+Cu
(4)滤渣E
快招解题法 试题秒解 考场速用
结合流程图分析如下:
发生反应:
Zn+CuSO₄=Cu+ZnSO₄
CaCO₃、粉末CuSO₄、Zn 足量水 步骤① 过滤 滤液A 溶质为ZnSO₄,可能有未反应的CuSO₄
滤液B CaCO₃、Cu、可能有过量的Zn
步骤② 加入过量稀盐酸 滤渣D 滤液D HCl,可能有ZnCl₂、Cu
Ca(OH)₂溶液或Ba(OH)₂溶液 足量甲溶液 步骤③ 产生白色沉淀 溶质为CaCl₂、
气体C 可能有H₂ CO₂,产生白色沉淀 CaCO₃或BaCO₃
(1)步骤③产生白色沉淀,说明步骤②中碳酸钙与稀盐酸反应生成了二氧化碳,由此可以证明待测粉末中一定含有碳酸钙。
(2)步骤②加入过量稀盐酸得到滤渣E,说明滤渣B中含有不与酸反应的物质,则一定含有锌与硫酸铜反应生成的铜,说明固体粉末中一定含有硫酸铜。
更多讲解详见《解题有招》折页“快招7”
(1)氢氧化钙溶液(或氢氧化钡溶液) 碳酸钙
(2)步骤②加入过量稀盐酸得到滤渣E
(3)Zn+CuSO₄=ZnSO₄+Cu
(4)滤渣E
快招解题法 试题秒解 考场速用
结合流程图分析如下:
发生反应:
Zn+CuSO₄=Cu+ZnSO₄
CaCO₃、粉末CuSO₄、Zn 足量水 步骤① 过滤 滤液A 溶质为ZnSO₄,可能有未反应的CuSO₄
滤液B CaCO₃、Cu、可能有过量的Zn
步骤② 加入过量稀盐酸 滤渣D 滤液D HCl,可能有ZnCl₂、Cu
Ca(OH)₂溶液或Ba(OH)₂溶液 足量甲溶液 步骤③ 产生白色沉淀 溶质为CaCl₂、
气体C 可能有H₂ CO₂,产生白色沉淀 CaCO₃或BaCO₃
(1)步骤③产生白色沉淀,说明步骤②中碳酸钙与稀盐酸反应生成了二氧化碳,由此可以证明待测粉末中一定含有碳酸钙。
(2)步骤②加入过量稀盐酸得到滤渣E,说明滤渣B中含有不与酸反应的物质,则一定含有锌与硫酸铜反应生成的铜,说明固体粉末中一定含有硫酸铜。
更多讲解详见《解题有招》折页“快招7”
16. (5分)根据图1、图2所示的实验回答问题。
(1)图1是探究酸碱性质的实验。一段时间后,可观察到的现象是
(2)图2是探究二氧化碳性质的实验。观察到只有
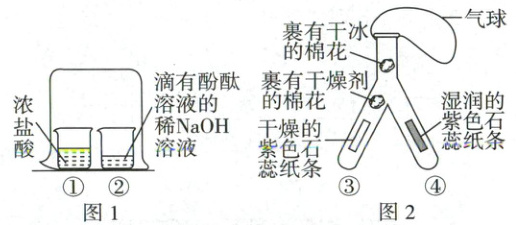
(1)图1是探究酸碱性质的实验。一段时间后,可观察到的现象是
滴有酚酞溶液的稀NaOH溶液的红色褪去
,从微观角度分析,产生该现象的原因是氢离子和氢氧根离子结合生成水分子
。(2)图2是探究二氧化碳性质的实验。观察到只有
④
(填“③”或“④”)处的纸条变为红色;小明认为将Y形管口的气球取下对该实验影响不大,理由是二氧化碳的密度比空气大,即使没有气球,二氧化碳也能与湿润的石蕊纸条充分接触
。将变红的纸条取出放置在空气中足够长的时间,可观察到试纸由红色变回紫色
。
答案:
16
(1)滴有酚酞溶液的稀NaOH溶液的红色褪去 氢离子和氢氧根离子结合生成水分子
(2)④ 二氧化碳的密度比空气大,即使没有气球,二氧化碳也能与湿润的石蕊纸条充分接触 试纸由红色变回紫色
【解题思路】
(1)结合图示分析如下:
(2)二氧化碳不能使紫色石蕊变色,二氧化碳和水反应生成碳酸,碳酸可使紫色石蕊变红色,图 2 可观察到③处干燥的紫色石蕊纸条不变色,④处湿润的紫色石蕊纸条变红色;将 Y 形管口的气球取下对该实验影响不大,因为二氧化碳的密度比空气大,即使没有气球,二氧化碳也能与湿润的石蕊纸条充分接触;由于碳酸易分解生成二氧化碳和水,将变红的试纸取出放置在空气中足够长的时间,碳酸分解,则可观察到试纸由红色变回紫色。
16
(1)滴有酚酞溶液的稀NaOH溶液的红色褪去 氢离子和氢氧根离子结合生成水分子
(2)④ 二氧化碳的密度比空气大,即使没有气球,二氧化碳也能与湿润的石蕊纸条充分接触 试纸由红色变回紫色
【解题思路】
(1)结合图示分析如下:

(2)二氧化碳不能使紫色石蕊变色,二氧化碳和水反应生成碳酸,碳酸可使紫色石蕊变红色,图 2 可观察到③处干燥的紫色石蕊纸条不变色,④处湿润的紫色石蕊纸条变红色;将 Y 形管口的气球取下对该实验影响不大,因为二氧化碳的密度比空气大,即使没有气球,二氧化碳也能与湿润的石蕊纸条充分接触;由于碳酸易分解生成二氧化碳和水,将变红的试纸取出放置在空气中足够长的时间,碳酸分解,则可观察到试纸由红色变回紫色。
17. (7分)三星堆金面罩青铜人头像(如图所示)的发掘为研究古蜀文明的宗教信仰、工艺水平等方面提供了极为珍贵的实物资料。青铜器是中华民族文化传承的重要载体,化学课外实践小组同学围绕着青铜器开展了如下实践活动。

活动一:认识古代青铜的炼制
资料显示,古人主要使用孔雀石[一种绿色的矿石,主要成分为碱式碳酸铜${Cu_{2}(OH)_{2}CO_{3}}$]炼铜。小组同学结合所学知识设计了如图所示的生产流程炼铜。

(1)试剂X的名称是
(2)该方案中物质A循环利用的意义是
(3)古代很多兵器都用青铜铸造,用青铜而不用纯铜的原因是
青铜器本身呈金黄色,历经岁月侵蚀,表面生成了青绿色的铜锈(主要成分为碱式碳酸铜),故被人们称为“青铜”。
活动二:探究铜生锈的条件
【作出猜想】(4)铜生锈是铜与空气中的氧气、水和
【进行实验】同学们按照如图所示进行了实验,并进行了观察。

(5)试剂X是
(6)依据现象
拓展延伸
人类改造自然就是利用人类的智慧,提取、净化、制造、应用的过程,而大自然的力量就是腐蚀、分散,使物质以合适的方式再回归大自然。

活动一:认识古代青铜的炼制
资料显示,古人主要使用孔雀石[一种绿色的矿石,主要成分为碱式碳酸铜${Cu_{2}(OH)_{2}CO_{3}}$]炼铜。小组同学结合所学知识设计了如图所示的生产流程炼铜。

(1)试剂X的名称是
炭(合理即可)
。转化③的化学方程式为CO+CuO △ Cu+CO₂
。(2)该方案中物质A循环利用的意义是
节约资源,有利于环保
。(3)古代很多兵器都用青铜铸造,用青铜而不用纯铜的原因是
青铜的硬度比纯铜大
。青铜器本身呈金黄色,历经岁月侵蚀,表面生成了青绿色的铜锈(主要成分为碱式碳酸铜),故被人们称为“青铜”。
活动二:探究铜生锈的条件
【作出猜想】(4)铜生锈是铜与空气中的氧气、水和
二氧化碳(或CO₂)
共同作用的结果。【进行实验】同学们按照如图所示进行了实验,并进行了观察。

(5)试剂X是
氢氧化钠溶液
。(6)依据现象
甲中铜丝生锈,乙、丙和丁中铜丝不生锈
,可知猜想成立。拓展延伸
人类改造自然就是利用人类的智慧,提取、净化、制造、应用的过程,而大自然的力量就是腐蚀、分散,使物质以合适的方式再回归大自然。
答案:
17
(1)炭(合理即可) CO+CuO △ Cu+CO₂
(2)节约资源,有利于环保
(3)青铜的硬度比纯铜大
(4)二氧化碳(或CO₂)
(5)氢氧化钠溶液
(6)甲中铜丝生锈,乙、丙和丁中铜丝不生锈
【解题思路】
(1)碱式碳酸铜加热分解生成氧化铜、二氧化碳和水,则A为二氧化碳,转化②二氧化碳和炭高温下反应生成一氧化碳,则试剂X为炭;转化③为一氧化碳和氧化铜在加热条件下反应生成铜和二氧化碳,化学方程式为CO+CuO △ Cu+CO₂。
(3)青铜是铜的合金,则青铜的硬度比纯铜大(合金的硬度一般比其组成中纯金属的硬度大)。
(4)根据质量守恒定律,化学反应前后元素种类不变,碱式碳酸铜是由铜、碳、氢、氧四种元素组成的,则铜生锈是铜与空气中的氧气、水和二氧化碳共同作用的结果。
(5)
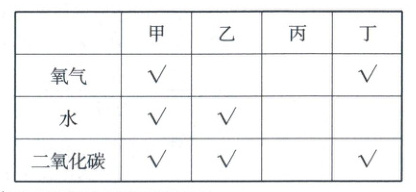
(“√”表示铜丝与该物质接触)
由以上表格分析丙中铜丝应该是与氧气、水接触,则试剂X可以除去二氧化碳,根据二氧化碳能与氢氧化钠溶液反应生成碳酸钠和水,则可用氢氧化钠溶液吸收二氧化碳气体,故试剂X为氢氧化钠溶液。
17
(1)炭(合理即可) CO+CuO △ Cu+CO₂
(2)节约资源,有利于环保
(3)青铜的硬度比纯铜大
(4)二氧化碳(或CO₂)
(5)氢氧化钠溶液
(6)甲中铜丝生锈,乙、丙和丁中铜丝不生锈
【解题思路】
(1)碱式碳酸铜加热分解生成氧化铜、二氧化碳和水,则A为二氧化碳,转化②二氧化碳和炭高温下反应生成一氧化碳,则试剂X为炭;转化③为一氧化碳和氧化铜在加热条件下反应生成铜和二氧化碳,化学方程式为CO+CuO △ Cu+CO₂。
(3)青铜是铜的合金,则青铜的硬度比纯铜大(合金的硬度一般比其组成中纯金属的硬度大)。
(4)根据质量守恒定律,化学反应前后元素种类不变,碱式碳酸铜是由铜、碳、氢、氧四种元素组成的,则铜生锈是铜与空气中的氧气、水和二氧化碳共同作用的结果。
(5)

(“√”表示铜丝与该物质接触)
由以上表格分析丙中铜丝应该是与氧气、水接触,则试剂X可以除去二氧化碳,根据二氧化碳能与氢氧化钠溶液反应生成碳酸钠和水,则可用氢氧化钠溶液吸收二氧化碳气体,故试剂X为氢氧化钠溶液。
查看更多完整答案,请扫码查看


