2025年金版新学案高中化学选择性必修第一册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年金版新学案高中化学选择性必修第一册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第85页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
4. 适量的肥料能促进植物生长,其原因是人工施用肥料后,植物选择性地吸收必要的营养元素离子,达到促进生长的作用。
(1) 用NH₄Cl作氮肥,长期施用土壤会变酸,用离子方程式表示原因:
(2) 植物能吸收NH₄⁺,请用化学用语表示NH₃·H₂O能提供NH₄⁺的原因:
(3) 铁肥(FeSO₄)与钾肥(K₂CO₃)不能同时施用,为弄清原因,某研究小组展开实验探究。
资料:①FeCO₃是白色固体。②H₂CO₃需要达到一定浓度才能以CO₂形式逸出。
【提出猜想】
猜想1:反应生成FeCO₃沉淀。
猜想2:生成Fe(OH)₂沉淀。
【实验探究】
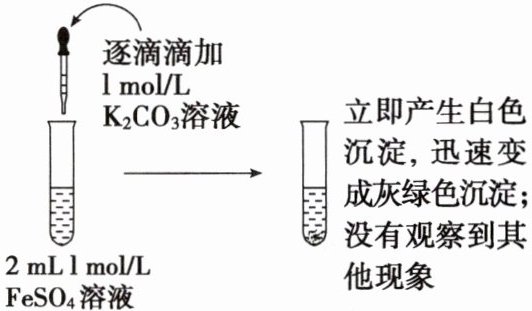
【得出结论】 根据实验现象,说明猜想
【实验反思】 实验中还发现,FeSO₄溶液放置一段时候后颜色变黄,请你作为科学宣讲团,从化学角度为农民保存和施用铁肥提出建议(答出2点):
(1) 用NH₄Cl作氮肥,长期施用土壤会变酸,用离子方程式表示原因:
$\mathrm{NH_4^++H_2O\rightleftharpoons NH_3· H_2O+H^+}$
。(2) 植物能吸收NH₄⁺,请用化学用语表示NH₃·H₂O能提供NH₄⁺的原因:
$\mathrm{NH_3· H_2O\rightleftharpoons NH_4^++OH^-}$
。(3) 铁肥(FeSO₄)与钾肥(K₂CO₃)不能同时施用,为弄清原因,某研究小组展开实验探究。
资料:①FeCO₃是白色固体。②H₂CO₃需要达到一定浓度才能以CO₂形式逸出。
【提出猜想】
猜想1:反应生成FeCO₃沉淀。
猜想2:生成Fe(OH)₂沉淀。
【实验探究】

【得出结论】 根据实验现象,说明猜想
2
成立,写出反应的离子反应方程式:$\mathrm{Fe^{2+}+CO_3^{2-}+2H_2O=Fe(OH)_2\downarrow+H_2CO_3}$
。【实验反思】 实验中还发现,FeSO₄溶液放置一段时候后颜色变黄,请你作为科学宣讲团,从化学角度为农民保存和施用铁肥提出建议(答出2点):
保存在干燥的地方,并密封保存
、不能与溶液呈碱性的肥料同时施用
。
答案:
4.
(1)$\mathrm{NH_4^++H_2O\rightleftharpoons NH_3· H_2O+H^+}$
(2)$\mathrm{NH_3· H_2O\rightleftharpoons NH_4^++OH^-}$
(3)$2\mathrm{Fe^{3+}+CO_3^{2-}+2H_2O=Fe(OH)_2\downarrow+H_2CO_3}$保存在干燥的地方,并密封保存不能与溶液呈碱性的肥料同时施用
解析:
(1)氯化铵是强酸弱碱盐,铵根离子在溶液中水解使溶液呈酸性,水解的离子方程式为$\mathrm{NH_4^++H_2O\rightleftharpoons NH_3· H_2O+H^+}$;
(2)一水合氨是弱碱,在溶液中部分电离出能被植物吸收的铵根离子和氢氧根离子,电离方程式为$\mathrm{NH_3· H_2O\rightleftharpoons NH_4^++OH^-}$;
(3)由实验现象可知,生成的白色沉淀为氢氧化亚铁,但未观察到气泡,说明硫酸亚铁溶液与碳酸钾溶液发生相互促进的水解反应生成氢氧化亚铁沉淀和碳酸,所以猜想2成立,反应的离子方程式为$\mathrm{Fe^{2+}+CO_3^{2-}+2H_2O=Fe(OH)_2\downarrow+H_2CO_3}$;为防止铁肥在保存时发生水解及被空气中氧气氧化,硫酸亚铁固体应保存在干燥的地方,并密封保存,施用时为防止硫酸亚铁转化为氢氧化亚铁,不能与溶液呈碱性的肥料同时施用。
(1)$\mathrm{NH_4^++H_2O\rightleftharpoons NH_3· H_2O+H^+}$
(2)$\mathrm{NH_3· H_2O\rightleftharpoons NH_4^++OH^-}$
(3)$2\mathrm{Fe^{3+}+CO_3^{2-}+2H_2O=Fe(OH)_2\downarrow+H_2CO_3}$保存在干燥的地方,并密封保存不能与溶液呈碱性的肥料同时施用
解析:
(1)氯化铵是强酸弱碱盐,铵根离子在溶液中水解使溶液呈酸性,水解的离子方程式为$\mathrm{NH_4^++H_2O\rightleftharpoons NH_3· H_2O+H^+}$;
(2)一水合氨是弱碱,在溶液中部分电离出能被植物吸收的铵根离子和氢氧根离子,电离方程式为$\mathrm{NH_3· H_2O\rightleftharpoons NH_4^++OH^-}$;
(3)由实验现象可知,生成的白色沉淀为氢氧化亚铁,但未观察到气泡,说明硫酸亚铁溶液与碳酸钾溶液发生相互促进的水解反应生成氢氧化亚铁沉淀和碳酸,所以猜想2成立,反应的离子方程式为$\mathrm{Fe^{2+}+CO_3^{2-}+2H_2O=Fe(OH)_2\downarrow+H_2CO_3}$;为防止铁肥在保存时发生水解及被空气中氧气氧化,硫酸亚铁固体应保存在干燥的地方,并密封保存,施用时为防止硫酸亚铁转化为氢氧化亚铁,不能与溶液呈碱性的肥料同时施用。
典例1
ROH是一元弱碱,难溶盐RA、RB的两饱和溶液中$c(A^-)$或$c(B^-)$随$c(OH^-)$而变化,$A^-$、$B^-$不发生水解。实验发现,298 K时$c^2(A^-)$与$c(OH^-)$或$c^2(B^-)$与$c(OH^-)$的关系如图所示,甲表示$c^2(A^-)$与$c(OH^-)$关系。下列叙述错误的是(
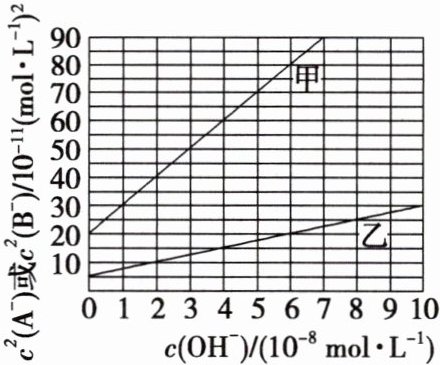
A.RA饱和溶液在$pH=6$时,$c(A^-)\approx1.73×10^{-5}\ mol·L^{-1}$
B.RB的溶度积$K_{sp}(RB)$的数值为$5×10^{-11}$
C.ROH的电离常数$K_{b}(ROH)$的数值为$2×10^{-6}$
D.当RB的饱和溶液$pH=7$时,可能有$c(R^+)+c(H^+)\lt c(B^-)+c(OH^-)$
ROH是一元弱碱,难溶盐RA、RB的两饱和溶液中$c(A^-)$或$c(B^-)$随$c(OH^-)$而变化,$A^-$、$B^-$不发生水解。实验发现,298 K时$c^2(A^-)$与$c(OH^-)$或$c^2(B^-)$与$c(OH^-)$的关系如图所示,甲表示$c^2(A^-)$与$c(OH^-)$关系。下列叙述错误的是(
C
)
A.RA饱和溶液在$pH=6$时,$c(A^-)\approx1.73×10^{-5}\ mol·L^{-1}$
B.RB的溶度积$K_{sp}(RB)$的数值为$5×10^{-11}$
C.ROH的电离常数$K_{b}(ROH)$的数值为$2×10^{-6}$
D.当RB的饱和溶液$pH=7$时,可能有$c(R^+)+c(H^+)\lt c(B^-)+c(OH^-)$
答案:
典例1 C RA饱和溶液pH=6时,c(H⁺)=$10^{-6}$ mol/L,c(OH⁻)=$10^{-8}$ mol/L,据图可知此时$c^{2}(A^{2-})$=$30 × 10^{-11} (mol/L)^{2}$,所以$c(A^{2-}) \approx 1.73 × 10^{-5} mol/L$,A项正确;RB的饱和溶液中存在平衡RB(s)⇌R⁺(aq)+B⁻(aq)、R⁺+H₂O⇌ROH+H⁺,当溶液酸性越强,R⁺的水解程度越弱,c(R⁺)和c(B⁻)的大小越接近,据图可知当c(OH⁻)接近0时(酸性强),$c^{2}(B^{-})$=$5 × 10^{-11} (mol/L)^{2}$,此时c(R⁺)=c(B⁻),$K_{sp}(RB)$=c(R⁺)·c(B⁻)=$c^{2}(B^{-})$=$5 × 10^{-11}$,B项正确;RB溶液中存在元素守恒c(R⁺)+c(ROH)=c(B⁻),$K_{b}(ROH)$=$\frac{c(OH^{-}) · c(R^{+})}{c(ROH)}$,若调节pH使碱性增强且加入的碱不是ROH,则c(R⁺)=c(ROH)时,满足c(R⁺)=c(ROH)=$\frac{1}{2}$c(B⁻),$K_{sp}(RB)$=c(R⁺)·c(B⁻)=$\frac{1}{2}$c(B⁻)·c(B⁻)=$5 × 10^{-11}$,所以此时$c^{2}(B^{-})$=$10 × 10^{-11} (mol/L)^{2}$,据图可知此时c(OH⁻)=$2 × 10^{-8}$ mol/L,即$K_{b}(ROH)$=$2 × 10^{-8}$,C项错误;RB饱和溶液若不加入其他物质,由于R⁺的水解,溶液会显酸性,所以pH=7时需要加入碱,若加入的碱不是ROH,则还有其他阳离子,此时根据电荷守恒可知c(R⁺)+c(H⁺)<c(B⁻)+c(OH⁻),D项正确。
查看更多完整答案,请扫码查看


