2025年金版新学案高中化学选择性必修第一册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年金版新学案高中化学选择性必修第一册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第3页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
[交流研讨]
H₂(g) + Cl₂(g) = 2HCl(g)的能量变化如下图所示:
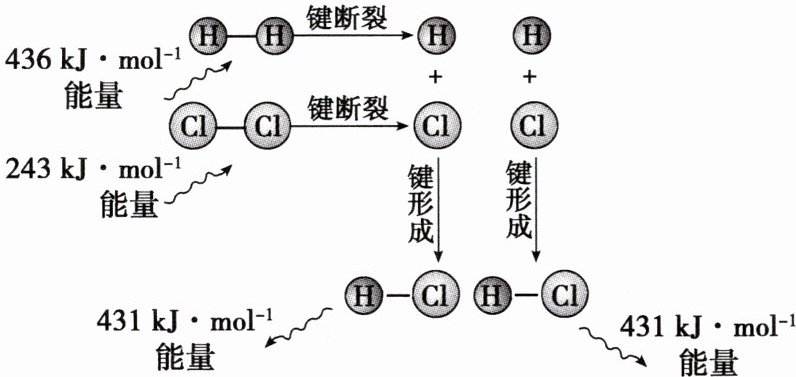
(键能:在25℃和101 kPa下,气态分子中1 mol化学键解离成气态原子所吸收的能量),请同学们讨论回答,该反应的焓变是多少?
H₂(g) + Cl₂(g) = 2HCl(g)的能量变化如下图所示:

(键能:在25℃和101 kPa下,气态分子中1 mol化学键解离成气态原子所吸收的能量),请同学们讨论回答,该反应的焓变是多少?
答案:
[交流研讨] ΔH = (436 + 243) kJ·mol⁻¹ - (431 + 431) kJ·mol⁻¹ = -183 kJ·mol⁻¹,ΔH = 反应物总键能 - 生成物总键能。
1. 判断正误
(1) 化学变化中的能量变化都是化学能与热能间的相互转化。(
(2) 在一个化学反应中,当反应物总焓大于生成物的总焓时,反应放热,ΔH为负值。(
(3) 浓硫酸溶于水时,体系的温度升高,该过程属于放热反应。(
(4) 石墨转化为金刚石需要吸收能量,所以石墨更稳定。(
(1) 化学变化中的能量变化都是化学能与热能间的相互转化。(
错误
)(2) 在一个化学反应中,当反应物总焓大于生成物的总焓时,反应放热,ΔH为负值。(
正确
)(3) 浓硫酸溶于水时,体系的温度升高,该过程属于放热反应。(
错误
)(4) 石墨转化为金刚石需要吸收能量,所以石墨更稳定。(
正确
)
答案:
1.
(1)错误;化学变化中的能量变化除了化学能与热能间的相互转化,还有与光能、电能等其他形式能的转化。
(2)正确。
(3)错误;该过程是物理变化,不是化学反应。
(4)正确。
(1)错误;化学变化中的能量变化除了化学能与热能间的相互转化,还有与光能、电能等其他形式能的转化。
(2)正确。
(3)错误;该过程是物理变化,不是化学反应。
(4)正确。
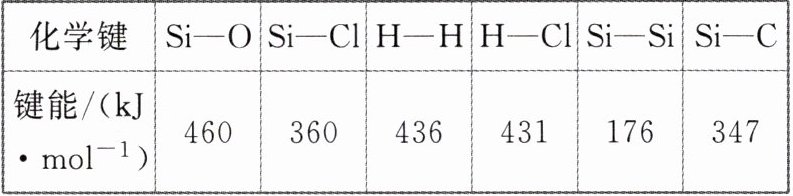
2. 通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热。已知:1 mol晶体硅中含有2 mol Si—Si键,工业上高纯硅可通过下列反应制取:SiCl₄(g) + 2H₂(g) $\xlongequal{高温}$ Si(s) + 4HCl(g),该反应的ΔH为
+236 kJ·mol⁻¹
。
答案:
2.+236 kJ·mol⁻¹
解析:反应热 = 反应物的键能之和 - 生成物的键能之和,即ΔH = 360 kJ·mol⁻¹×4 + 436 kJ·mol⁻¹×2 - 176 kJ·mol⁻¹×2 - 431 kJ·mol⁻¹×4 = +236 kJ·mol⁻¹。
解析:反应热 = 反应物的键能之和 - 生成物的键能之和,即ΔH = 360 kJ·mol⁻¹×4 + 436 kJ·mol⁻¹×2 - 176 kJ·mol⁻¹×2 - 431 kJ·mol⁻¹×4 = +236 kJ·mol⁻¹。
1. 下图表示有关反应的反应过程与能量变化的关系。下列说法错误的是(

A.ΔH₁ < 0
B.S(s)比S(g)稳定
C.ΔH₁ > ΔH₂
D.S(s)转化为S(g)是吸热过程
C
)
A.ΔH₁ < 0
B.S(s)比S(g)稳定
C.ΔH₁ > ΔH₂
D.S(s)转化为S(g)是吸热过程
答案:
1.C 反应物总能量大于生成物的总能量为放热反应,ΔH < 0,A正确;物质的能量越低越稳定,S(s)比S(g)稳定,B正确;两个反应均为放热反应,焓变均小于0,根据纵坐标分析,ΔH₁绝对值大于ΔH₂的绝对值,ΔH₁ < ΔH₂,C错误;S(s)能量低于S(g),S(s)转化为S(g)是吸热过程,D正确。
2. 物质变化与能量变化是化学反应的两大特征,下列有关化学反应中的能量变化说法不正确的是(

A.所有的化学反应都有能量变化,一个反应不是吸热就是放热
B.反应A + B = C的过程如图所示,可知该反应为放热反应
C.乙醇燃烧生成CO₂(g)和H₂O(l)是放热反应,说明乙醇断键吸收的能量比形成CO₂(g)和H₂O(l)放出的总能量少
D.吸热反应需要加热才能进行,放热反应都不需要加热
D
)
A.所有的化学反应都有能量变化,一个反应不是吸热就是放热
B.反应A + B = C的过程如图所示,可知该反应为放热反应
C.乙醇燃烧生成CO₂(g)和H₂O(l)是放热反应,说明乙醇断键吸收的能量比形成CO₂(g)和H₂O(l)放出的总能量少
D.吸热反应需要加热才能进行,放热反应都不需要加热
答案:
2.D 依据化学反应的实质分析,化学反应过程中一定有新物质生成,断裂化学键吸收能量,形成化学键放出能量,反应过程中一定伴随能量变化,反应不是吸热就是放热,故A正确;由图可知A + B的总能量高于C,该反应为放热反应,故B正确;乙醇燃烧为放热反应,反应物断键所吸收的总能量低于生成物形成键所放出的总能量,故C正确;反应的吸放热与反应条件无关,吸热反应不一定需要加热,如氯化铵与氢氧化钡晶体常温下即可反应;放热反应有些也需要加热甚至高温,如铝热反应,故D错误。
3. 已知化学反应A₂(g) + B₂(g) = 2AB(g)的能量变化如图所示,判断下列叙述中正确的是(
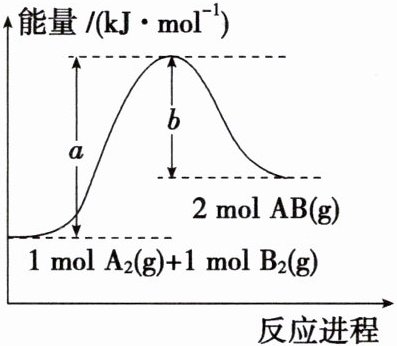
A.该反应有可能是放热反应
B.1 mol A₂(g)和1 mol B₂(g)反应生成2 mol AB(g)吸收的热量为(a - b) kJ
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B键,放出a kJ能量
B
)
A.该反应有可能是放热反应
B.1 mol A₂(g)和1 mol B₂(g)反应生成2 mol AB(g)吸收的热量为(a - b) kJ
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B键,放出a kJ能量
答案:
3.B 由图可知,生成物的总能量大于反应物的总能量,该反应为吸热反应,A项错误;该反应为吸热反应,1 mol A₂(g)和1 mol B₂(g)反应生成2 mol AB(g)吸收的热量为(a - b) kJ,B项正确;由图可知,生成物的总能量高于反应物的总能量,C项错误;断裂化学键吸收能量,根据图示可知断裂1 mol A—A和1 mol B—B键,吸收a kJ能量,D项错误;答案选B。
查看更多完整答案,请扫码查看


