2025年金版新学案高中化学选择性必修第一册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年金版新学案高中化学选择性必修第一册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第79页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
任务一 盐类的水解
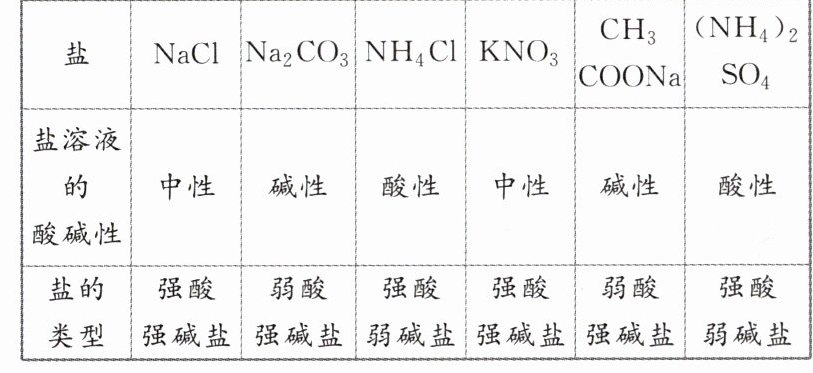
一、盐溶液的酸碱性
[交流研讨 1] 请分析下表实验结果,归纳盐溶液的酸碱性与盐的类型之间的关系。

答案:
一[交流研讨1] 盐溶液的酸碱性与盐的组成类型有关,强酸强碱盐溶液呈中性,弱酸强碱盐溶液呈碱性,强酸弱碱盐溶液呈酸性。
二、盐溶液呈现不同酸碱性的原因
1. NH₄Cl 溶液


2. CH₃COONa 溶液


3. Na₂CO₃ 溶液
由于 H₂CO₃ 是二元酸,Na₂CO₃ 溶液水解分两步进行:
CO₃²⁻ + H₂O ⇌ OH⁻ + HCO₃⁻
HCO₃⁻ + H₂O ⇌ OH⁻ + H₂CO₃
4. NaCl 溶液
H₂O ⇌ OH⁻ + H⁺,NaCl = Na⁺ + Cl⁻,溶液中盐电离的离子不能与 H₂O 电离出的 H⁺或 OH⁻生成________。溶液中 c(H⁺)________c(OH⁻),溶液呈________性。
答案:
二、1.$\text{NH}_3\cdot\text{H}_2\text{O}$ 右 > 酸 2.$\text{CH}_3\text{COO}^-$ $\text{H}^+$ $\text{CH}_3\text{COOH}$ < 碱 4.弱电解质 = 中
三、盐类水解
1. 盐类水解的实质
盐与水反应,生成酸和碱的反应称为盐类水解,盐类水解是________的逆反应。在溶液中盐电离出来的________结合水电离出的 H⁺或 OH⁻生成弱电解质(弱酸或者弱碱),破坏了水的电离平衡,________了水的电离,使溶液显示不同的酸性、碱性或中性。

2. 盐类水解的规律
在可溶性盐溶液中:有弱才水解,越弱越水解,都弱都水解,谁强显谁性(水解同电性)。
答案:
三、1.酸碱中和反应 弱酸根离子(或弱碱阳离子) 促进
查看更多完整答案,请扫码查看


