4. 在“质量守恒定律”的课堂教学中,老师引导同学们进行“化学反应前后物质的质量关系”的实验探究。如下图所示,A、B、C、D 四个实验分别由甲、乙、丙、丁四个组的同学来完成,他们都进行了规范的操作、准确的称量和细致的观察。
A.
B.
C.
D.
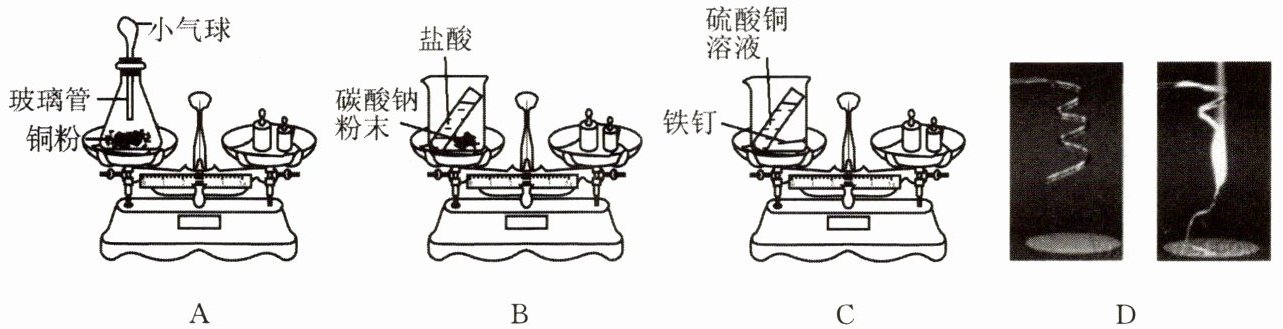
(1) A 实验:刚停止加热,就立即将锥形瓶放到天平上,天平不平衡。结论:质量不守恒。待锥形瓶冷却后,重新放到天平上,天平平衡。结论:质量守恒。其中结论正确的是______(填“前一种”或“后一种”),而另一种结论错误的原因是______。
(2) 丙组同学认为 C 实验说明化学反应前后质量守恒。请你从原子的角度说明原因:______。
(3) 乙、丁两组同学得到的错误结论是“实验 B、D 均说明质量不守恒”。老师引导同学们分析了 B、D 两个实验反应前后天平不平衡的原因,其中 B 实验天平不平衡的原因是______,该反应的化学方程式为______。
(4) 如果你是丁组的同学之一,你猜想:化学反应后剩余固体的质量与实验前镁条的质量相比有什么变化?理由是什么?(回答一种情况即可)
你的猜想是______。
你的理由是______。
A.
B.
C.
D.

(1) A 实验:刚停止加热,就立即将锥形瓶放到天平上,天平不平衡。结论:质量不守恒。待锥形瓶冷却后,重新放到天平上,天平平衡。结论:质量守恒。其中结论正确的是______(填“前一种”或“后一种”),而另一种结论错误的原因是______。
(2) 丙组同学认为 C 实验说明化学反应前后质量守恒。请你从原子的角度说明原因:______。
(3) 乙、丁两组同学得到的错误结论是“实验 B、D 均说明质量不守恒”。老师引导同学们分析了 B、D 两个实验反应前后天平不平衡的原因,其中 B 实验天平不平衡的原因是______,该反应的化学方程式为______。
(4) 如果你是丁组的同学之一,你猜想:化学反应后剩余固体的质量与实验前镁条的质量相比有什么变化?理由是什么?(回答一种情况即可)
你的猜想是______。
你的理由是______。
答案:
(1)后一种 空气受热体积膨胀,使气球胀大,产生向上的浮力
(2)化学反应前后,原子的种类、数目、质量都不变
(3)碳酸钠和盐酸反应有气泡冒出
${Na_{2}CO_{3} + 2HCl \xlongequal{} 2NaCl + H_{2}O + CO_{2}\uparrow}$
(4)化学反应后剩余固体的质量比实验前镁条的质量增加了(合理即可) 镁与氧气在点燃的条件下反应生成氧化镁,有氧气参加反应(合理即可)
(1)后一种 空气受热体积膨胀,使气球胀大,产生向上的浮力
(2)化学反应前后,原子的种类、数目、质量都不变
(3)碳酸钠和盐酸反应有气泡冒出
${Na_{2}CO_{3} + 2HCl \xlongequal{} 2NaCl + H_{2}O + CO_{2}\uparrow}$
(4)化学反应后剩余固体的质量比实验前镁条的质量增加了(合理即可) 镁与氧气在点燃的条件下反应生成氧化镁,有氧气参加反应(合理即可)
5. 实践活动:
查阅资料,了解质量守恒定律的发现过程,以及科学家们对此所作的贡献。
查阅资料,了解质量守恒定律的发现过程,以及科学家们对此所作的贡献。
答案:
1. 17世纪,波义耳:在敞口容器中加热金属汞,发现反应后质量增加,未发现质量守恒定律。
2. 18世纪,罗蒙诺索夫:在密闭容器中进行金属煅烧实验,发现反应前后质量不变,提出质量守恒思想。
3. 18世纪末,拉瓦锡:通过大量精确实验(如氧化汞分解与合成),确认化学反应前后物质总质量不变,正式确立质量守恒定律。
2. 18世纪,罗蒙诺索夫:在密闭容器中进行金属煅烧实验,发现反应前后质量不变,提出质量守恒思想。
3. 18世纪末,拉瓦锡:通过大量精确实验(如氧化汞分解与合成),确认化学反应前后物质总质量不变,正式确立质量守恒定律。
查看更多完整答案,请扫码查看


