2024年优加学案课时通九年级化学全一册鲁教版54制
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2024年优加学案课时通九年级化学全一册鲁教版54制 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第67页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
8. 向盛有一定量硫酸铜溶液的烧杯中逐渐加入铁粉,相关量的变化如图所示,下列说法错误的是( )
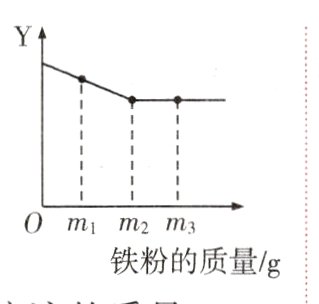
A. 纵坐标Y可以表示烧杯内溶液的质量
B. 加入m₁g铁粉充分反应后,烧杯内有两种固体单质
C. 加入m₂g铁粉充分反应后,烧杯内溶液的颜色为浅绿色
D. 加入m₃g铁粉充分反应后,烧杯内溶液中只有一种金属离子

A. 纵坐标Y可以表示烧杯内溶液的质量
B. 加入m₁g铁粉充分反应后,烧杯内有两种固体单质
C. 加入m₂g铁粉充分反应后,烧杯内溶液的颜色为浅绿色
D. 加入m₃g铁粉充分反应后,烧杯内溶液中只有一种金属离子
答案:
B
9. (2023·齐齐哈尔中考)将一定质量的金属镁放入硝酸银和硝酸铜的混合溶液中,充分反应后过滤,得到滤渣和滤液,下列说法正确的是( )
A. 若滤液为无色,则滤渣中一定含有镁
B. 若向滤渣中加入稀盐酸,没有气泡产生,则滤渣中一定含有银和铜
C. 若滤液为蓝色,则滤液中至少含有三种金属离子
D. 若加入镁的质量为2.4g,则滤渣的质量一定大于2.4g
A. 若滤液为无色,则滤渣中一定含有镁
B. 若向滤渣中加入稀盐酸,没有气泡产生,则滤渣中一定含有银和铜
C. 若滤液为蓝色,则滤液中至少含有三种金属离子
D. 若加入镁的质量为2.4g,则滤渣的质量一定大于2.4g
答案:
D 解析:由金属活动性$Mg>Cu>Ag$知,将一定质量的金属镁放入硝酸银和硝酸铜的混合溶液中,镁先与$AgNO_{3}$反应生成硝酸镁和银,$AgNO_{3}$反应完,若还有镁粉,镁才能与$Cu(NO_{3})_{2}$反应生成硝酸镁和铜。若滤液为无色,则说明滤液中一定不含硝酸铜,可能是恰好完全反应,则滤渣中不一定含有镁,A错误。若向滤渣中加入稀盐酸,没有气泡产生,则滤渣中一定含有银,可能含有铜,B错误。若滤液为蓝色,说明滤液中含有硝酸铜,则滤液中至少含有镁离子、铜离子两种金属离子,可能含有银离子,C错误。
10. 为验证铁、铜、银的金属活动性顺序,某同学设计了如图所示四组实验。下列说法错误的是( )
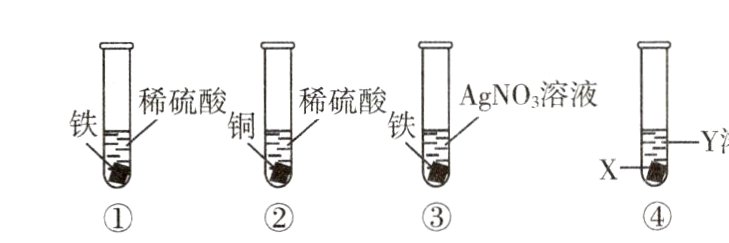
A. 通过实验①②,能验证金属活动性:Fe>Cu
B. 通过实验①②③,能验证金属活动性:Fe>Cu>Ag
C. 实验④中若X为Cu,Y为FeSO₄溶液,能验证金属活动性:Fe>Cu
D. 实验④中若X为Cu,Y为AgNO₃溶液,能验证金属活动性:Cu>Ag

A. 通过实验①②,能验证金属活动性:Fe>Cu
B. 通过实验①②③,能验证金属活动性:Fe>Cu>Ag
C. 实验④中若X为Cu,Y为FeSO₄溶液,能验证金属活动性:Fe>Cu
D. 实验④中若X为Cu,Y为AgNO₃溶液,能验证金属活动性:Cu>Ag
答案:
B 解析:①中产生气泡,是因为铁与稀硫酸反应生成了氢气,说明铁排在氢前面,②中铜与稀硫酸不反应,说明铜排在氢后面,能验证金属活动性$Fe>Cu$,③中铁表面析出银白色固体,是因为铁与硝酸银反应生成了银,说明铁比银活泼,但不能比较铜和银的活动性,B错误。
11. 在两只烧杯中分别放入相同质量的镁、锌两种金属,然后向两只烧杯中分别倒入相同质量、相同质量分数的稀硫酸,反应产生氢气的质量与消耗硫酸的质量关系如图所示。以下结论合理的是( )
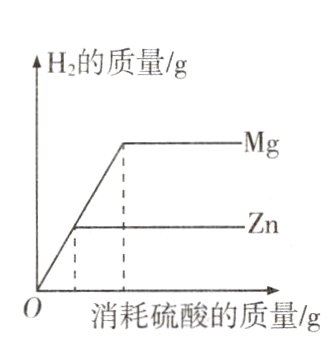
A. 据图像可知,金属镁比金属锌活动性强
B. 若两种金属都有剩余,两者得到的氢气质量相同
C. 若硫酸有剩余,两者得到氢气的质量相同
D. 若两种金属完全溶解,两者消耗硫酸的质量相同

A. 据图像可知,金属镁比金属锌活动性强
B. 若两种金属都有剩余,两者得到的氢气质量相同
C. 若硫酸有剩余,两者得到氢气的质量相同
D. 若两种金属完全溶解,两者消耗硫酸的质量相同
答案:
B 解析:题图是产生氢气的质量与消耗硫酸的质量之间的关系,不能判断镁和锌的金属活动性,A不合理;若两种金属都有剩余,说明硫酸不足,生成氢气质量取决于反应的硫酸的质量,两只烧杯中分别倒入的是相同质量、相同质量分数的稀硫酸,说明硫酸质量相等,因此两者得到的氢气质量相同,B合理;稀硫酸和镁、锌反应的化学方程式及其质量关系如下:
$Mg + H_{2}SO_{4} = MgSO_{4} + H_{2}\uparrow$
24 98 2
$Zn + H_{2}SO_{4} = ZnSO_{4} + H_{2}\uparrow$
65 98 2
由以上质量关系可知,若硫酸有剩余,说明硫酸过量,生成氢气的质量取决于金属的质量,相等质量的镁、锌完全反应时,镁反应生成的氢气多,因此两者得到氢气的质量不相同,C不合理;由以上质量关系可知,若两种金属完全溶解,两者消耗硫酸的质量不相同,即镁消耗的硫酸多,D不合理。
$Mg + H_{2}SO_{4} = MgSO_{4} + H_{2}\uparrow$
24 98 2
$Zn + H_{2}SO_{4} = ZnSO_{4} + H_{2}\uparrow$
65 98 2
由以上质量关系可知,若硫酸有剩余,说明硫酸过量,生成氢气的质量取决于金属的质量,相等质量的镁、锌完全反应时,镁反应生成的氢气多,因此两者得到氢气的质量不相同,C不合理;由以上质量关系可知,若两种金属完全溶解,两者消耗硫酸的质量不相同,即镁消耗的硫酸多,D不合理。
12. (2023·遂宁中考)学习了金属与盐反应的知识,小雨同学在“实验开放日”,将一定量的锌粉加入硝酸银溶液中,充分反应后过滤,得到滤渣和滤液,她对滤液中溶质成分产生了兴趣并作进一步探究。
[提出问题]滤液中溶质是什么?
[猜想与假设]猜想一:AgNO₃;
猜想二:Zn(NO₃)₂;
猜想三:AgNO₃、Zn(NO₃)₂。
经分析猜想一错误,其理由是________________。
[设计并进行实验]
|
[反思与拓展]
(1)反应物的量不同,可能导致得到的物质种类不同。
(2)滤渣中含有________。
[提出问题]滤液中溶质是什么?
[猜想与假设]猜想一:AgNO₃;
猜想二:Zn(NO₃)₂;
猜想三:AgNO₃、Zn(NO₃)₂。
经分析猜想一错误,其理由是________________。
[设计并进行实验]
|

[反思与拓展]
(1)反应物的量不同,可能导致得到的物质种类不同。
(2)滤渣中含有________。
答案:
[猜想与假设]在金属活动性顺序中,锌排在银前面,故锌粉可以将银从银的盐溶液中置换出来,而锌会以锌离子的形式存在于溶液中,故滤液中的溶质不可能只有硝酸银
[设计并进行实验]产生白色沉淀 $AgNO_{3} + NaCl = AgCl\downarrow + NaNO_{3}$
[反思与拓展]
(2)Ag
[设计并进行实验]产生白色沉淀 $AgNO_{3} + NaCl = AgCl\downarrow + NaNO_{3}$
[反思与拓展]
(2)Ag
查看更多完整答案,请扫码查看


