2024年优加学案课时通九年级化学全一册鲁教版54制
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2024年优加学案课时通九年级化学全一册鲁教版54制 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第44页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
6. 除去食盐溶液中的$Na_{2}SO_{4}$和$CaCl_{2}$杂质的操作有:①加入过量$BaCl_{2}$溶液;②过滤;③加入适量盐酸;④蒸发结晶;⑤加入过量$Na_{2}CO_{3}$溶液。正确的操作顺序是( )
A. ①⑤②③④
B. ③①⑤②④
C. ①③⑤④②
D. ⑤③②①④
A. ①⑤②③④
B. ③①⑤②④
C. ①③⑤④②
D. ⑤③②①④
答案:
A 解析:硫酸根离子用钡离子沉淀,加入过量的氯化钡溶液可以将硫酸根离子除去;钙离子用碳酸根离子沉淀,除去钙离子可加入过量的碳酸钠溶液转化为沉淀,但是加入碳酸钠溶液要放在加入氯化钡溶液之后,这样碳酸钠会除去反应剩余的氯化钡;完全反应后,再进行过滤,最后再加入盐酸除去反应剩余的碳酸根离子,最后进行蒸发,所以正确的顺序为①⑤②③④.
7.(传统文化)《天工开物》中对“海水盐”有如下描述:“凡煎盐锅古谓之‘牢盆’,……其下列灶燃薪,多者十二三眼,少者七八眼,共煎此盘,……火燃釜底,滚沸延及成盐。”文中没有涉及的操作是( )
A. 加热
B. 结晶
C. 蒸发
D. 过滤
A. 加热
B. 结晶
C. 蒸发
D. 过滤
答案:
D
8.(2023·银川四模)用下列实验操作可以完成两个实验,甲实验是除去粗盐中的难溶性固体杂质,乙实验是配制溶质质量分数为10%的氯化钠溶液。下列说法正确的是( )

A. 甲实验的步骤是①④⑤,其中除杂质的关键步骤是蒸发
B. 甲实验④中,玻璃棒的作用是搅拌,加快过滤速度
C. 乙实验若按②③①的步骤进行操作,所配溶液的浓度会偏小(水的密度为$1 g·cm^{-3})$
D. 乙实验②中,若左盘放砝码,右盘放药品,所称得的氯化钠一定比实际需要量少

A. 甲实验的步骤是①④⑤,其中除杂质的关键步骤是蒸发
B. 甲实验④中,玻璃棒的作用是搅拌,加快过滤速度
C. 乙实验若按②③①的步骤进行操作,所配溶液的浓度会偏小(水的密度为$1 g·cm^{-3})$
D. 乙实验②中,若左盘放砝码,右盘放药品,所称得的氯化钠一定比实际需要量少
答案:
D 解析:粗盐中难溶性杂质的去除的操作步骤是溶解、过滤、蒸发,即步骤是①④⑤,其中去除杂质的关键一步是过滤(把不溶于液体的固体与液体分离的一种方法),A错误。步骤④是过滤操作,玻璃棒的作用是引流,B错误。配制一定溶质质量分数的溶液的步骤是计算、称量(量取)、溶解,乙实验按照②③①的步骤进行操作,③中量取的水的体积偏小,则配制溶液的浓度偏大,C错误。乙实验②中,若左盘放砝码,右盘放药品,且使用了游码,所称得的氯化钠一定比实际需要量少,D正确。
9. 海水晒盐的原理是利用风吹日晒蒸发海水中的水分,使氯化钠晶体析出。如图所示能正确表示海水晒盐过程中,海水中NaCl的质量分数(A%)与蒸发时间(t)的关系的是( )
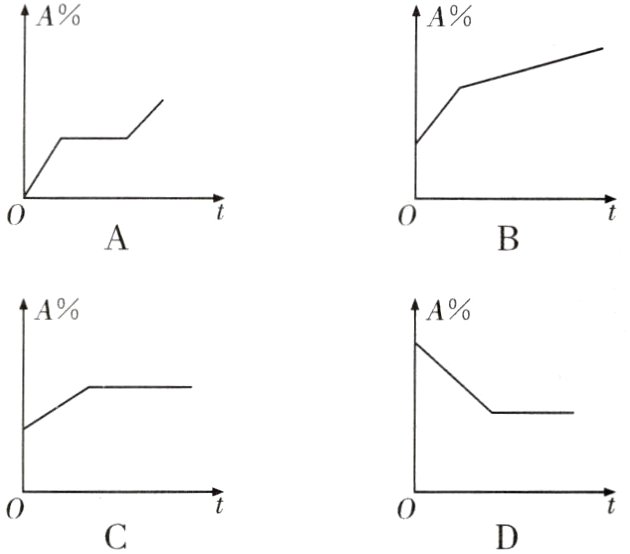

答案:
C
10.(应用题)海水晒盐可得到大量粗盐。某氯碱厂用电解精制饱和食盐水法制取NaOH,产生的$H_{2}$和$Cl_{2}$还可用于制盐酸,工艺流程如图所示。相关说法不正确的是( )

A. H_{2}和Cl_{2}制盐酸,发生的化学反应为$H_{2}+Cl_{2}\stackrel{点燃}{=\!=\!=}2HCl$
B. 精制时去除粗盐中的$Ca^{2+}、$$Mg^{2+}、$$SO_{4}^{2-},$依次加入的试剂顺序为NaOH、$Na_{2}CO_{3}、$$BaCl_{2}、$HCl
C. 电解时发生的反应为$2NaCl + 2H_{2}O\stackrel{通电}{=\!=\!=}2NaOH + H_{2}\uparrow + Cl_{2}\uparrow$,该过程电能转化为化学能
D. 脱盐工序是利用NaCl和NaOH在溶解度上的差异,通过蒸发结晶、趁热过滤分离得到NaCl晶体和NaOH溶液

A. H_{2}和Cl_{2}制盐酸,发生的化学反应为$H_{2}+Cl_{2}\stackrel{点燃}{=\!=\!=}2HCl$
B. 精制时去除粗盐中的$Ca^{2+}、$$Mg^{2+}、$$SO_{4}^{2-},$依次加入的试剂顺序为NaOH、$Na_{2}CO_{3}、$$BaCl_{2}、$HCl
C. 电解时发生的反应为$2NaCl + 2H_{2}O\stackrel{通电}{=\!=\!=}2NaOH + H_{2}\uparrow + Cl_{2}\uparrow$,该过程电能转化为化学能
D. 脱盐工序是利用NaCl和NaOH在溶解度上的差异,通过蒸发结晶、趁热过滤分离得到NaCl晶体和NaOH溶液
答案:
B 解析:精制时去除粗盐中的$\mathrm{Ca}^{2 + }$、$\mathrm{Mg}^{2 + }$、$\mathrm{SO}_{4}^{2 - }$,由于每一步为使杂质完全沉淀,加入的除杂剂都要过量,所以后期需要把加入的过量除杂剂去除,所以依次加入的试剂顺序应为$\mathrm{NaOH}$、$\mathrm{BaCl}_{2}$、$\mathrm{Na}_{2}\mathrm{CO}_{3}$、$\mathrm{HCl}$,这样过量的氯化钡可以用碳酸钠进行沉淀,而过量的碳酸钠可以用盐酸除去,最后盐酸在蒸发时挥发掉。B错误。
11.(传统文化)我国古代“布灰种盐”生产海盐,其过程为“烧草为灰,布在滩场,然后以海水渍之,俟晒结浮白,扫而复淋”。
(1)“晒结浮白”是指海水浸渍的草灰经日晒后出现白色海盐颗粒的过程,化学上称之为________。
(2)经过多次“扫而复淋”,提高卤水浓度获得“上等卤水”(氯化钠的质量分数约为15%),用于煎炼海盐。1 000 g“上等卤水”蒸干后,可得氯化钠的质量约为________g。
(3)氯化钠在生产生活中的用途之一是________。
(1)“晒结浮白”是指海水浸渍的草灰经日晒后出现白色海盐颗粒的过程,化学上称之为________。
(2)经过多次“扫而复淋”,提高卤水浓度获得“上等卤水”(氯化钠的质量分数约为15%),用于煎炼海盐。1 000 g“上等卤水”蒸干后,可得氯化钠的质量约为________g。
(3)氯化钠在生产生活中的用途之一是________。
答案:
(1)蒸发结晶
(2)150
(3)作调味品
(1)蒸发结晶
(2)150
(3)作调味品
查看更多完整答案,请扫码查看


