第87页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
18. 金属材料在日常生活和工业上有着广泛的应用。
(1)铁是生活中应用最多的金属。铁易生锈,铁锈的主要成分是$Fe_{2}O_{3}$,$Fe_{2}O_{3}$的物质类别是______(填“酸”“碱”“盐”或“氧化物”),铁锈可用稀硫酸除去,写出反应的化学方程式:______,反应现象是______。
(2)铝具有良好的延展性。“延展性”属于
(3)古法炼铜的原理如下:以孔雀石和木炭为原料,高温煅烧使孔雀石分解生成氧化铜、二氧化碳和水,氧化铜再与木炭反应得到铜。已知:孔雀石的主要成分是碱式碳酸铜$[Cu_{2}(OH)_{2}CO_{3}]$。写出古法炼铜过程中发生的两个反应的化学方程式:
(4)人类大规模使用金属单质的顺序是铜、铁、铝,请分析产生上述顺序的原因可能是______(写出一条即可)。
(1)铁是生活中应用最多的金属。铁易生锈,铁锈的主要成分是$Fe_{2}O_{3}$,$Fe_{2}O_{3}$的物质类别是______(填“酸”“碱”“盐”或“氧化物”),铁锈可用稀硫酸除去,写出反应的化学方程式:______,反应现象是______。
(2)铝具有良好的延展性。“延展性”属于
物理
(填“物理”或“化学”)性质。冶炼铝时,先将冰晶石高温熔化,再将$Al_{2}O_{3}$加入,待$Al_{2}O_{3}$溶解后进行电解,该过程中冰晶石可以看作溶剂
(填“溶质”或“溶剂”)。(3)古法炼铜的原理如下:以孔雀石和木炭为原料,高温煅烧使孔雀石分解生成氧化铜、二氧化碳和水,氧化铜再与木炭反应得到铜。已知:孔雀石的主要成分是碱式碳酸铜$[Cu_{2}(OH)_{2}CO_{3}]$。写出古法炼铜过程中发生的两个反应的化学方程式:
Cu₂(OH)₂CO₃\xlongequal{\triangle}2CuO+CO₂↑+H₂O
、C+2CuO\xlongequal{高温}2Cu+CO₂↑
。(4)人类大规模使用金属单质的顺序是铜、铁、铝,请分析产生上述顺序的原因可能是______(写出一条即可)。
答案:
18.
(1)氧化物Fe₂O₃+3H₂SO₄=Fe₂(SO₄)₃+3H₂O 红色固体溶解,溶液变棕黄色
(2)物理溶剂
$(3)Cu₂(OH)₂CO₃\overset{\triangle}{=}2CuO+CO₂↑+H₂O C+2CuO\overset{高温}{=}2Cu+CO₂↑$
(4)金属活动性越强,冶炼的难度越大(合理即可)
(1)氧化物Fe₂O₃+3H₂SO₄=Fe₂(SO₄)₃+3H₂O 红色固体溶解,溶液变棕黄色
(2)物理溶剂
$(3)Cu₂(OH)₂CO₃\overset{\triangle}{=}2CuO+CO₂↑+H₂O C+2CuO\overset{高温}{=}2Cu+CO₂↑$
(4)金属活动性越强,冶炼的难度越大(合理即可)
19. 某学校化学兴趣小组设计出右图所示装置,并进行白磷燃烧实验。
(1)本实验中装置$A$在使用前需要检查
(2)当烧杯内的水受热,温度计显示$25^{\circ}C$时,打开分液漏斗的活塞,盛有水的试管中有气泡均匀逸出,白磷未燃烧,关闭活塞。锥形瓶内反应的化学方程式是______。白磷与氧气接触,但未燃烧的原因是______。

(3)随着水温升高,温度计显示$45^{\circ}C$时,再次打开活塞,很快白磷在水里燃烧。常言道“水火不相容”,而此时白磷在水里能够燃烧的原因是______。白磷燃烧的化学方程式是______。
(4)本实验采用水浴加热,该方法比直接加热的好处是
(1)本实验中装置$A$在使用前需要检查
气密性
。(2)当烧杯内的水受热,温度计显示$25^{\circ}C$时,打开分液漏斗的活塞,盛有水的试管中有气泡均匀逸出,白磷未燃烧,关闭活塞。锥形瓶内反应的化学方程式是______。白磷与氧气接触,但未燃烧的原因是______。

(3)随着水温升高,温度计显示$45^{\circ}C$时,再次打开活塞,很快白磷在水里燃烧。常言道“水火不相容”,而此时白磷在水里能够燃烧的原因是______。白磷燃烧的化学方程式是______。
(4)本实验采用水浴加热,该方法比直接加热的好处是
水浴加热可使试管受热更均匀
(写出一点即可)。
答案:
19.
(1)气密性
$(2)2H₂O₂\overset{MnO₂}{=}2H₂O+O₂↑ $温度没有达到白磷的着火点
(3)白磷与氧气接触,且温度达到了白磷的着火点$ 4P+5O₂\overset{点燃}{=}2P₂O₅$
(4)水浴加热可使试管受热更均匀
(1)气密性
$(2)2H₂O₂\overset{MnO₂}{=}2H₂O+O₂↑ $温度没有达到白磷的着火点
(3)白磷与氧气接触,且温度达到了白磷的着火点$ 4P+5O₂\overset{点燃}{=}2P₂O₅$
(4)水浴加热可使试管受热更均匀
20. 某校学生学习了金属的化学性质后进行了以下问题的探究。
(1)探究金属的活动性顺序
如图所示,在白色点滴板的孔穴$1$、$2$、$3$中分别滴加两滴稀盐酸,在白色点滴板的孔穴$4$、$5$、$6$中分别滴加两滴硫酸铜溶液。
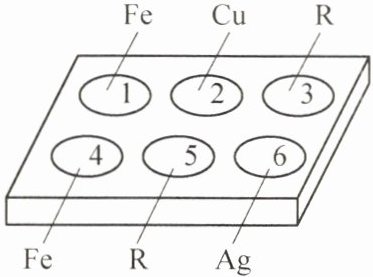
①孔穴$1$、$3$有气泡生成,写出孔穴$1$中发生反应的化学方程式:______。
②孔穴$4$的实验现象是
③若只选用两个孔穴比较就能得出$R$、$Cu$、$Ag$三种金属的活动性顺序,这两个孔穴的编号是
(2)从废液中回收金属
某工厂的废液中含有硝酸亚铁、硝酸铜和硝酸银,为回收金属$Ag$,某同学设计了如下方案。

①写出废液中加入$Cu$发生反应的化学方程式:
②为了达到同样的实验目的,步骤Ⅰ中稍过量的$Cu$
(3)研究黄铜($Cu-Zn$合金)中铜的质量分数
取$20g$黄铜样品置于烧杯中,加入足量的稀硫酸,反应生成$0.2g$氢气,计算黄铜样品中铜的质量分数。(根据化学方程式列式计算)
(1)探究金属的活动性顺序
如图所示,在白色点滴板的孔穴$1$、$2$、$3$中分别滴加两滴稀盐酸,在白色点滴板的孔穴$4$、$5$、$6$中分别滴加两滴硫酸铜溶液。

①孔穴$1$、$3$有气泡生成,写出孔穴$1$中发生反应的化学方程式:______。
②孔穴$4$的实验现象是
铁表面产生红色固体
。③若只选用两个孔穴比较就能得出$R$、$Cu$、$Ag$三种金属的活动性顺序,这两个孔穴的编号是
5、6
。(2)从废液中回收金属
某工厂的废液中含有硝酸亚铁、硝酸铜和硝酸银,为回收金属$Ag$,某同学设计了如下方案。

①写出废液中加入$Cu$发生反应的化学方程式:
Cu+2AgNO₃=2Ag+Cu(NO₃)₂
。②为了达到同样的实验目的,步骤Ⅰ中稍过量的$Cu$
能
(填“能”或“不能”)换成稍过量的$Fe$。(3)研究黄铜($Cu-Zn$合金)中铜的质量分数
取$20g$黄铜样品置于烧杯中,加入足量的稀硫酸,反应生成$0.2g$氢气,计算黄铜样品中铜的质量分数。(根据化学方程式列式计算)
答案:
20.
(1)①Fe+2HCl=FeCl₂+H₂↑ ②铁表面产生红色固体 ③5、6
(2)①Cu+2AgNO₃=2Ag+Cu(NO₃)₂ ②能
(3)[解]设:消耗Zn的质量为x。
Zn+H₂SO₄=ZnSO₄+H₂↑
65 2
x 0.2g
$\frac{65}{2}=\frac{x}{0.2g} x=6.5g$
样品中铜的质量=20g-6.5g=13.5g
样品中铜的质量分数$=\frac{13.5}{20}×100\%=67.5\%$
(1)①Fe+2HCl=FeCl₂+H₂↑ ②铁表面产生红色固体 ③5、6
(2)①Cu+2AgNO₃=2Ag+Cu(NO₃)₂ ②能
(3)[解]设:消耗Zn的质量为x。
Zn+H₂SO₄=ZnSO₄+H₂↑
65 2
x 0.2g
$\frac{65}{2}=\frac{x}{0.2g} x=6.5g$
样品中铜的质量=20g-6.5g=13.5g
样品中铜的质量分数$=\frac{13.5}{20}×100\%=67.5\%$
查看更多完整答案,请扫码查看


