第38页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
1. 不同的酸在水溶液中都能离解出
H⁺
,因此酸有一些相似的性质(即酸的通性)。不同的酸在水溶液中,离解出不同的酸根离子
,从而导致它们的化学性质有差异。
答案:
1. H⁺ 酸根离子
2. 盐是由
金属离子
(或铵根)和酸根离子
构成的化合物。能与酸
反应生成盐
和水
的氧化物叫做碱性氧化物,大多数金属
氧化物是碱性氧化物。
答案:
2. 金属离子 酸根离子 酸 盐水 金属
3. 酸的一些化学性质
(1) 酸能使指示剂变色,如可使紫色石蕊试液变
(2) 酸能与一些金属反应生成
(3) 酸能与一些金属氧化物反应生成
(4) 酸能与一些盐反应生成新的______和新的______,如 $ {CaCO_{3} + 2HCl =} $______,$ {BaCl_{2} + H_{2}SO_{4} =} $______。
(1) 酸能使指示剂变色,如可使紫色石蕊试液变
红
色。(2) 酸能与一些金属反应生成
盐
和氢气
,如 $ {Fe + 2HCl =} $FeCl₂ + H₂↑
。(3) 酸能与一些金属氧化物反应生成
盐
和水
,如 $ {Fe_{2}O_{3} + 6HCl =} $2FeCl₃ + 3H₂O
。(4) 酸能与一些盐反应生成新的______和新的______,如 $ {CaCO_{3} + 2HCl =} $______,$ {BaCl_{2} + H_{2}SO_{4} =} $______。
答案:
3.
(1)红
(2)盐 氢气 FeCl₂ + H₂↑
(3)盐水 2FeCl₃ + 3H₂O
(4)盐酸 CaCl₂ + H₂O + CO₂↑ BaSO₄↓ + 2HCl
(1)红
(2)盐 氢气 FeCl₂ + H₂↑
(3)盐水 2FeCl₃ + 3H₂O
(4)盐酸 CaCl₂ + H₂O + CO₂↑ BaSO₄↓ + 2HCl
4. 酸的用途
(1) 盐酸可用于金属表面
(2) 人体胃液中含有
(3) 硫酸可用于生产
(4) 水垢主要成分是
(1) 盐酸可用于金属表面
除锈
、制造药物
。(2) 人体胃液中含有
盐酸
,可帮助消化。(3) 硫酸可用于生产
化肥
、农药,以及冶炼金属、精炼石油和金属除锈
等。(4) 水垢主要成分是
碳酸钙
和氢氧化镁
等物质,生活中常用食醋去除水垢。
答案:
4.
(1)除锈 药物
(2)盐酸
(3)化肥 除锈
(4)碳酸钙 氢氧化镁
(1)除锈 药物
(2)盐酸
(3)化肥 除锈
(4)碳酸钙 氢氧化镁
1. 酸具有相似的化学性质是因为它们的组成中都有(
A.酸根
B.氢离子
C.氧元素
D.水
B
)A.酸根
B.氢离子
C.氧元素
D.水
答案:
1. B
2. 下列物质中属于碱性氧化物的是(
A.$ {MgO} $
B.$ {CO_{2}} $
C.$ {H_{2}O} $
D.$ {CO} $
A
)A.$ {MgO} $
B.$ {CO_{2}} $
C.$ {H_{2}O} $
D.$ {CO} $
答案:
2. A
3. 以下试剂中可以除去铁锈的是(
A.石灰水
B.食盐水
C.稀硫酸
D.苏打水
C
)A.石灰水
B.食盐水
C.稀硫酸
D.苏打水
答案:
3. C
4. 下列能用来鉴别稀盐酸和稀硫酸的是(
A.$ {BaCl_{2}} $溶液
B.$ {AgNO_{3}} $溶液
C.$ {Na_{2}CO_{3}} $溶液
D.紫色石蕊试液
A
)A.$ {BaCl_{2}} $溶液
B.$ {AgNO_{3}} $溶液
C.$ {Na_{2}CO_{3}} $溶液
D.紫色石蕊试液
答案:
4. A [解析]BaCl₂溶液和硫酸反应会产生白色沉淀,和盐酸不反应,无明显现象,可以鉴别。AgNO₃溶液分别与两者反应都会产生白色沉淀。Na₂CO₃溶液分别与两者反应都会产生气泡。两者都能使紫色石蕊试液变红色。
5. 实验室用 $ 4 {g} $氢氧化钠配制少量溶液和盐酸反应,配制过程中溶质部分变质为碳酸钠。则使用该溶液与足量盐酸反应,消耗 $ {HCl} $的质量是(
A.$ 3.65 {g} $
B.$ 5.3 {g} $
C.$ 7.3 {g} $
D.$ 10.6 {g} $
A
)A.$ 3.65 {g} $
B.$ 5.3 {g} $
C.$ 7.3 {g} $
D.$ 10.6 {g} $
答案:
5. A [解析]题中涉及的反应包括NaOH + HCl = NaCl + H₂O、2NaOH + CO₂ = Na₂CO₃ + H₂O、Na₂CO₃ + 2HCl = 2NaCl + H₂O + CO₂↑。从质量守恒的角度可知,NaOH无论是否变质,消耗HCl的质量是不变的,因此可以直接利用NaOH的质量计算所需HCl的质量。
6. 向盛有一定量氧化铁的烧杯中不断滴入稀硫酸,烧杯中有关量的变化正确的是(
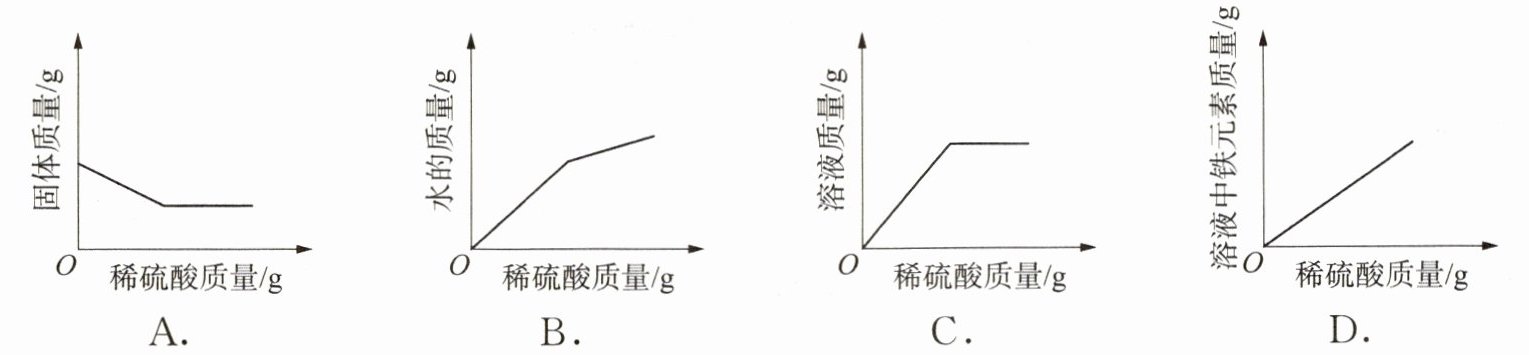
A.
B.
C.
D.
B
)
A.
B.
C.
D.
答案:
6. B [解析]Fe₂O₃ + 3H₂SO₄ = Fe₂(SO₄)₃ + 3H₂O,随着硫酸的加入,Fe₂O₃逐渐被消耗,反应结束时,氧化铁质量为0g,即使硫酸过量,固体质量仍为0g,所以A错误。随着硫酸的加入,反应结束前增加的水的质量=硫酸中溶剂水的质量+反应生成的水的质量;反应结束后,增加的水的质量仅仅是硫酸中溶剂水的质量,因此第一段水的质量增加快,第二段增加慢,故B正确。随着硫酸的加入,溶液的质量也会一直增加,因此C错。但要注意,溶液质量也应该是两段增长趋势不同的曲线,第一段增加的是参加反应的氧化铁和加入硫酸溶液的质量,第二段增加的是硫酸溶液的质量,因此C选项图像的变化趋势应该类似B选项。随着Fe₂O₃逐渐被消耗,溶液中铁元素的质量不断增加,当Fe₂O₃反应完后,铁元素的质量不再增加,故D错误。
查看更多完整答案,请扫码查看


