第76页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
14. 向一定量的铁粉与铜粉的混合物中逐滴加入稀硫酸至过量,下图是反应过程中某种物质的质量 $y$ 随加入稀硫酸质量 $x$ 变化的关系示意图,$y$ 不能表示的是(
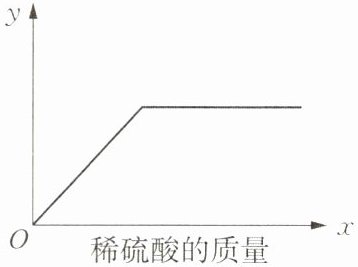
A.铜粉的质量
B.参与反应的铁粉质量
C.生成氢气的质量
D.生成硫酸亚铁的质量
A
)
A.铜粉的质量
B.参与反应的铁粉质量
C.生成氢气的质量
D.生成硫酸亚铁的质量
答案:
14.A
15. 质量为 $5.6\mathrm{g}$ 的铁粉中混有一种金属杂质,当这些铁粉跟足量的盐酸完全反应后,生成氢气 $0.22\mathrm{g}$,该铁粉中混有的金属杂质可能是(
A.镁
B.铝
C.锌
D.铜
AB
)A.镁
B.铝
C.锌
D.铜
答案:
15.AB [解析]与本练习第10题类似,跟盐酸反应产生0.2g氢气时,需要镁、铝、锌、铁的质量分别为2.4g、1.8g、6.5g和5.6g,铜不与酸反应,无氢气产生。题中混有金属杂质的5.6g铁粉跟酸反应产生了0.22g氢气,即等质量的这种金属杂质和盐酸反应产生氢气的量比铁多,选项中的镁、铝都符合。若5.6g铁粉中混有锌或铜的话,产生的氢气质量会小于0.20g。
16. 某兴趣小组从工厂收集到一些含有硫酸铜的废液以及废铁屑,制订了如下方案并进行了实验。有人认为固体 ${A}$ 就是要回收的金属铜,于是设计了两个方案,来推断固体 ${A}$ 的成分。




答案:
(1)没有;不能
(2)稀盐酸(或稀硫酸);Fe + 2HCl = FeCl₂ + H₂↑(或Fe + H₂SO₄ = FeSO₄ + H₂↑);铜和铁(或Cu和Fe)
(2)稀盐酸(或稀硫酸);Fe + 2HCl = FeCl₂ + H₂↑(或Fe + H₂SO₄ = FeSO₄ + H₂↑);铜和铁(或Cu和Fe)
17. 某化学活动小组为探究金属与酸反应的规律,在室温条件下进行了下图所示实验。

(试管内的镁条和铁片表面均被打磨洁净,且形状、大小相同;同时加入等质量、等溶质质量分数的稀硫酸)
(1) 甲中发生反应的化学方程式为:
(2) 通过观察到
(3) 通过观察到
(4) 若实验所用的金属均过量,则甲装置中产生 ${H_{2}}$ 的质量

(试管内的镁条和铁片表面均被打磨洁净,且形状、大小相同;同时加入等质量、等溶质质量分数的稀硫酸)
(1) 甲中发生反应的化学方程式为:
Mg+H₂SO₄=MgSO₄+H₂↑
。(2) 通过观察到
Mg与稀硫酸反应产生气泡比Fe与稀硫酸反应产生气泡快
的现象,可以比较镁和铁的金属活动性。(3) 通过观察到
甲中长颈漏斗内的液面比乙中液面上升更高
的现象可知,相同时间内镁与稀硫酸反应放出的热量比铁与稀硫酸反应放出的热量多。(4) 若实验所用的金属均过量,则甲装置中产生 ${H_{2}}$ 的质量
=
(填“>”“<”或“=”)乙装置中产生 ${H_{2}}$ 的质量。
答案:
17.
(1)Mg+H₂SO₄=MgSO₄+H₂↑
(2)Mg与稀硫酸反应产生气泡比Fe与稀硫酸反应产生气泡快
(3)甲中长颈漏斗内的液面比乙中液面上升更高
(4)=
(1)Mg+H₂SO₄=MgSO₄+H₂↑
(2)Mg与稀硫酸反应产生气泡比Fe与稀硫酸反应产生气泡快
(3)甲中长颈漏斗内的液面比乙中液面上升更高
(4)=
查看更多完整答案,请扫码查看


