第63页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
7. 今有$H_{2}和O_{2}$的混合气体10 g,点燃充分反应后,恢复到室温,气体的质量减少了9 g,则原混合气体中的成分不可能是 (
A.5 g$H_{2}$和5 g$O_{2}$
B.1 g$H_{2}$和9 g$O_{2}$
C.2 g$H_{2}$和8 g$O_{2}$
D.$H_{2}和O_{2}的质量比为1:4$
A
)A.5 g$H_{2}$和5 g$O_{2}$
B.1 g$H_{2}$和9 g$O_{2}$
C.2 g$H_{2}$和8 g$O_{2}$
D.$H_{2}和O_{2}的质量比为1:4$
答案:
A 解析:因气体减少的质量等于生成水的质量,设生成9g水需要氢气和氧气的质量分别为x和y。
2H₂ + O₂$\xlongequal{\text{点燃}}$2H₂O
4 32 36
x y 9g
$\frac{4}{36}=\frac{x}{9g}$,$\frac{32}{36}=\frac{y}{9g}$
解得x = 1g,y = 8g
当氢气剩余时,则氧气为8g,氢气为10g - 8g = 2g;
当氧气剩余时,则氢气为1g,氧气为10g - 1g = 9g。
综上所述,A项符合题意。
2H₂ + O₂$\xlongequal{\text{点燃}}$2H₂O
4 32 36
x y 9g
$\frac{4}{36}=\frac{x}{9g}$,$\frac{32}{36}=\frac{y}{9g}$
解得x = 1g,y = 8g
当氢气剩余时,则氧气为8g,氢气为10g - 8g = 2g;
当氧气剩余时,则氢气为1g,氧气为10g - 1g = 9g。
综上所述,A项符合题意。
8. (2024·荆州月考)将一定质量的碳酸钙和铜粉的混合物在空气中煅烧使其完全反应($2Cu+O_{2}\xlongequal {△}2CuO$,$CaCO_{3}\xlongequal {高温}CaO+CO_{2}\uparrow $)。若反应前后固体的质量保持不变,则原混合物中铜粉的质量分数为 (
A.25%
B.22%
C.36.2%
D.63.8%
D
)A.25%
B.22%
C.36.2%
D.63.8%
答案:
D 解析:若反应前后固体的质量保持不变,则参加反应的氧气与生成二氧化碳的质量相等。
设参加反应的氧气的质量为x,则根据如下质量关系可知混合物中铜粉的质量为4x;
2Cu + O₂$\xlongequal{\triangle}$2CuO
128 32
4x x
参加反应的氧气的质量为x,则生成二氧化碳的质量也是x,则根据如下质量关系可知混合物中碳酸钙的质量为$\frac{25}{11}x$;
CaCO₃$\xlongequal{\text{高温}}$CaO + CO₂↑
100 44
$\frac{25x}{11}$ x
则原混合物中铜粉的质量分数为$\frac{4x}{4x+\frac{25}{11}x}×100\%\approx63.8\%$
设参加反应的氧气的质量为x,则根据如下质量关系可知混合物中铜粉的质量为4x;
2Cu + O₂$\xlongequal{\triangle}$2CuO
128 32
4x x
参加反应的氧气的质量为x,则生成二氧化碳的质量也是x,则根据如下质量关系可知混合物中碳酸钙的质量为$\frac{25}{11}x$;
CaCO₃$\xlongequal{\text{高温}}$CaO + CO₂↑
100 44
$\frac{25x}{11}$ x
则原混合物中铜粉的质量分数为$\frac{4x}{4x+\frac{25}{11}x}×100\%\approx63.8\%$
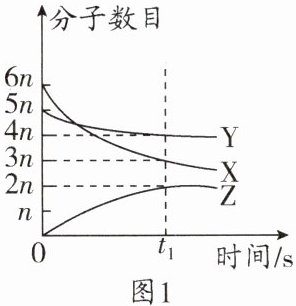
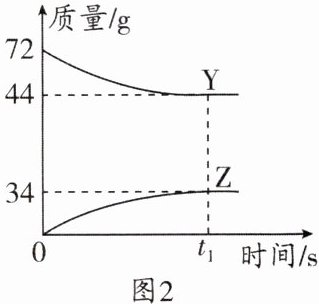
9. (2023·潍坊中考)某化学反应在密闭容器中进行,各物质的分子数目、质量随时间变化情况如图1、图2所示。下列说法错误的是 (
A.Z一定属于化合物
B.参加反应的X与Y的质量比为$3:14$
C.反应前后分子总数不变
D.Y与Z的相对分子质量之比为$28:17$
C
)

A.Z一定属于化合物
B.参加反应的X与Y的质量比为$3:14$
C.反应前后分子总数不变
D.Y与Z的相对分子质量之比为$28:17$
答案:
C 解析:由图1可知,X和Y是反应物,Z是生成物,由分子数目的变化情况可知,该反应可表示为3X + Y = 2Z。由图2可知,参加反应的Y的质量为72g - 44g = 28g,生成Z的质量为34g,由质量守恒定律可知:参加反应的X的质量为34g - 28g = 6g。根据分析可知,由该反应的化学方程式3X + Y = 2Z可知,该反应属于化合反应,因此生成物Z一定是化合物,A正确;由以上分析可知,参加反应的X与Y的质量比为6g:28g = 3:14,B正确;由该反应的化学方程式3X + Y = 2Z可知,反应前后分子总数改变,C错误;设Y、Z的相对分子质量分别为m、n,由化学方程式可知,$\frac{m}{2n}=\frac{28g}{34g}$,则$\frac{m}{n}=\frac{28}{17}$,D正确。
10. (2024·南通期中)二氧化碳和水在一种纳米催化剂表面可发生反应:$aCO_{2}+bH_{2}O\xlongequal {一定条件}cC_{4}H_{y}+dO_{2}$,反应中生成$O_{2}的质量随CO_{2}$质量的变化如图所示。下列说法正确的是 (

A.化学计量数$a:d= 2:1$
B.物质$C_{4}H_{y}$中碳元素的质量分数为75%
C.44 g$CO_{2}$参加反应时,生成$C_{4}H_{y}$的质量为8 g
D.44 g$CO_{2}$参加反应时,消耗$H_{2}O$的质量为72 g
B
)
A.化学计量数$a:d= 2:1$
B.物质$C_{4}H_{y}$中碳元素的质量分数为75%
C.44 g$CO_{2}$参加反应时,生成$C_{4}H_{y}$的质量为8 g
D.44 g$CO_{2}$参加反应时,消耗$H_{2}O$的质量为72 g
答案:
B 解析:由图可得,每消耗44g二氧化碳,便有64g氧气生成,由于二氧化碳的相对分子质量为44,氧气的相对分子质量为32,故二氧化碳和氧气的化学计量数之比为$\frac{44g}{44}:\frac{64g}{32}=1:2$,故a:d = 1:2,再根据反应前后各原子个数相等而推出C₄Hᵧ中的y = 16,b = 8,c = 1,可得化学方程式为4CO₂ + 8H₂O$\xlongequal{\text{一定条件}}$C₄H₁₆ + 8O₂,A错误;物质C₄H₁₆中碳元素的质量分数为$\frac{12×4}{12×4 + 1×16}×100\% = 75\%$,B正确;设生成C₄H₁₆的质量为x,则:
4CO₂ + 8H₂O$\xlongequal{\text{一定条件}}$C₄H₁₆ + 8O₂
176 64
44g x
$\frac{176}{64}=\frac{44g}{x}$,x = 16g
由化学方程式计算可知,44gCO₂参加反应时,生成C₄H₁₆的质量为16g,C错误;设消耗H₂O的质量为z,则:
4CO₂ + 8H₂O$\xlongequal{\text{一定条件}}$C₄H₁₆ + 8O₂
176 144
44g z
$\frac{176}{144}=\frac{44g}{z}$,z = 36g
由化学方程式计算可知,44gCO₂参加反应时,消耗H₂O的质量为36g,D错误。
4CO₂ + 8H₂O$\xlongequal{\text{一定条件}}$C₄H₁₆ + 8O₂
176 64
44g x
$\frac{176}{64}=\frac{44g}{x}$,x = 16g
由化学方程式计算可知,44gCO₂参加反应时,生成C₄H₁₆的质量为16g,C错误;设消耗H₂O的质量为z,则:
4CO₂ + 8H₂O$\xlongequal{\text{一定条件}}$C₄H₁₆ + 8O₂
176 144
44g z
$\frac{176}{144}=\frac{44g}{z}$,z = 36g
由化学方程式计算可知,44gCO₂参加反应时,消耗H₂O的质量为36g,D错误。
11. (2025·淄博月考)某碳酸钠样品中含有一定量的碳酸氢钠。为测定其纯度,取100 g样品加热至不再产生气体(化学方程式为$2NaHCO_{3}\xlongequal {△}Na_{2}CO_{3}+H_{2}O+CO_{2}\uparrow $),使生成的水完全被浓硫酸吸收,测得加热时间和浓硫酸质量增加的关系如表:
|时间/分钟|0|1|2|3|4|
|仪器和浓硫酸的质量总和/g|150|150.9|151.8|152.7|152.7|

(1)当完全反应后,生成水的质量为
(2)计算样品中碳酸氢钠的质量分数是多少?
解:设参加反应的碳酸氢钠的质量为x。
2NaHCO₃$\xlongequal{\triangle}$Na₂CO₃ + H₂O + CO₂↑
168 18
x 2.7g
$\frac{168}{18}=\frac{x}{2.7g}$
x = 25.2g
样品中碳酸氢钠的质量分数是$\frac{25.2g}{100g}×100\% = 25.2\%$
|时间/分钟|0|1|2|3|4|
|仪器和浓硫酸的质量总和/g|150|150.9|151.8|152.7|152.7|

(1)当完全反应后,生成水的质量为
2.7
g。(2)计算样品中碳酸氢钠的质量分数是多少?
解:设参加反应的碳酸氢钠的质量为x。
2NaHCO₃$\xlongequal{\triangle}$Na₂CO₃ + H₂O + CO₂↑
168 18
x 2.7g
$\frac{168}{18}=\frac{x}{2.7g}$
x = 25.2g
样品中碳酸氢钠的质量分数是$\frac{25.2g}{100g}×100\% = 25.2\%$
答案:
(1)2.7
(2)解:设参加反应的碳酸氢钠的质量为x。
2NaHCO₃$\xlongequal{\triangle}$Na₂CO₃ + H₂O + CO₂↑
168 18
x 2.7g
$\frac{168}{18}=\frac{x}{2.7g}$
x = 25.2g
样品中碳酸氢钠的质量分数是$\frac{25.2g}{100g}×100\% = 25.2\%$
解析:
(1)分析表格数据可知,仪器和浓硫酸的质量总和增加了152.7g - 150g = 2.7g,故生成水的质量为2.7g。
(1)2.7
(2)解:设参加反应的碳酸氢钠的质量为x。
2NaHCO₃$\xlongequal{\triangle}$Na₂CO₃ + H₂O + CO₂↑
168 18
x 2.7g
$\frac{168}{18}=\frac{x}{2.7g}$
x = 25.2g
样品中碳酸氢钠的质量分数是$\frac{25.2g}{100g}×100\% = 25.2\%$
解析:
(1)分析表格数据可知,仪器和浓硫酸的质量总和增加了152.7g - 150g = 2.7g,故生成水的质量为2.7g。
12. (2025·梅州期中)赤铁矿(主要成分为$Fe_{2}O_{3}$)是经济上最重要的矿物之一,在还原条件下,赤铁矿可转变为磁铁矿(主要成分为$Fe_{3}O_{4}$),称为假象磁铁矿。
(1)若$Fe_{2}O_{3}和Fe_{3}O_{4}$中铁元素的质量相同,$Fe_{2}O_{3}和Fe_{3}O_{4}$中氧元素质量的最简整数比为______
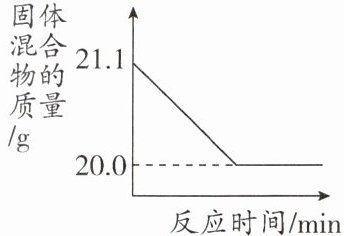
(2)赤铁矿经提纯后得到的纯净$Fe_{2}O_{3}$可用于生产某种工业催化剂(主要成分为FeO和$Fe_{2}O_{3}$),其反应原理为$2Fe_{2}O_{3}+C\xlongequal {高温}4FeO+CO_{2}\uparrow $。现将焦炭和过量的$Fe_{2}O_{3}$混合均匀,按上述原理充分反应,下图为固体混合物的质量随反应时间的变化曲线。
①由图可知:生成$CO_{2}$气体的质量为______
②计算反应后固体混合物中FeO的质量分数(写出计算过程)。
解:设反应后固体混合物中FeO的质量为x。
2Fe₂O₃ + C$\xlongequal{高温}$4FeO + CO₂↑
288 44
x 1.1g
$\frac{288}{44}=\frac{x}{1.1g}$
x = 7.2g
反应后固体混合物中FeO的质量分数为$\frac{7.2g}{20.0g}×100\% = 36.0\%$
答:反应后固体混合物中FeO的质量分数为36.0%。
(1)若$Fe_{2}O_{3}和Fe_{3}O_{4}$中铁元素的质量相同,$Fe_{2}O_{3}和Fe_{3}O_{4}$中氧元素质量的最简整数比为______
9:8
。(2)赤铁矿经提纯后得到的纯净$Fe_{2}O_{3}$可用于生产某种工业催化剂(主要成分为FeO和$Fe_{2}O_{3}$),其反应原理为$2Fe_{2}O_{3}+C\xlongequal {高温}4FeO+CO_{2}\uparrow $。现将焦炭和过量的$Fe_{2}O_{3}$混合均匀,按上述原理充分反应,下图为固体混合物的质量随反应时间的变化曲线。

①由图可知:生成$CO_{2}$气体的质量为______
1.1
g。②计算反应后固体混合物中FeO的质量分数(写出计算过程)。
解:设反应后固体混合物中FeO的质量为x。
2Fe₂O₃ + C$\xlongequal{高温}$4FeO + CO₂↑
288 44
x 1.1g
$\frac{288}{44}=\frac{x}{1.1g}$
x = 7.2g
反应后固体混合物中FeO的质量分数为$\frac{7.2g}{20.0g}×100\% = 36.0\%$
答:反应后固体混合物中FeO的质量分数为36.0%。
答案:
(1)9:8
(2)①1.1
②解:设反应后固体混合物中FeO的质量为x。
2Fe₂O₃ + C$\xlongequal{400 ^\circ\text{C}}$4FeO + CO₂↑
288 44
x 1.1g
$\frac{288}{44}=\frac{x}{1.1g}$
x = 7.2g
反应后固体混合物中FeO的质量分数为$\frac{7.2g}{20.0g}×100\% = 36.0\%$
答:反应后固体混合物中FeO的质量分数为36.0%。
解析:
(1)当Fe₂O₃和Fe₃O₄中铁元素质量相等时,铁的原子个数相等。由于每个Fe₂O₃分子中有2个铁原子,每个Fe₃O₄分子中有3个铁原子,因此要使铁元素质量相等,Fe₂O₃和Fe₃O₄的分子个数比应为3:2,由于每个Fe₂O₃分子中有3个氧原子,每个Fe₃O₄分子中有4个氧原子,则氧元素的质量比为(16×9):(16×8) = 9:8。
(2)①根据质量守恒定律,固体混合物减少的质量即为生成二氧化碳的质量,即21.1g - 20.0g = 1.1g。
(1)9:8
(2)①1.1
②解:设反应后固体混合物中FeO的质量为x。
2Fe₂O₃ + C$\xlongequal{400 ^\circ\text{C}}$4FeO + CO₂↑
288 44
x 1.1g
$\frac{288}{44}=\frac{x}{1.1g}$
x = 7.2g
反应后固体混合物中FeO的质量分数为$\frac{7.2g}{20.0g}×100\% = 36.0\%$
答:反应后固体混合物中FeO的质量分数为36.0%。
解析:
(1)当Fe₂O₃和Fe₃O₄中铁元素质量相等时,铁的原子个数相等。由于每个Fe₂O₃分子中有2个铁原子,每个Fe₃O₄分子中有3个铁原子,因此要使铁元素质量相等,Fe₂O₃和Fe₃O₄的分子个数比应为3:2,由于每个Fe₂O₃分子中有3个氧原子,每个Fe₃O₄分子中有4个氧原子,则氧元素的质量比为(16×9):(16×8) = 9:8。
(2)①根据质量守恒定律,固体混合物减少的质量即为生成二氧化碳的质量,即21.1g - 20.0g = 1.1g。
查看更多完整答案,请扫码查看


