第23页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
18.(1)某品牌矿泉水,其外包装上部分文字如图1所示,请回答下列问题。
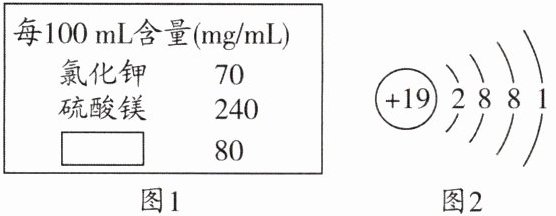
①硫酸镁中硫酸根离子的符号是
②已知钾原子的结构示意图如图2所示,则K⁺的质子数是
③已知标签中“□□”内的物质是氯化钙,则氯化钙的化学式是
(2)“用微观的眼光看世界”是学习化学的重要方法。如果用“●”表示一个氢原子,则“●●”表示
A.H₂ B.2H₂ C.2H D.$\stackrel{+1}{H}$

①硫酸镁中硫酸根离子的符号是
SO₄²⁻
。②已知钾原子的结构示意图如图2所示,则K⁺的质子数是
19
。③已知标签中“□□”内的物质是氯化钙,则氯化钙的化学式是
CaCl₂
。(2)“用微观的眼光看世界”是学习化学的重要方法。如果用“●”表示一个氢原子,则“●●”表示
C
,“●● ●●”表示B
。A.H₂ B.2H₂ C.2H D.$\stackrel{+1}{H}$
答案:
(1)①SO₄²⁻ ②19 ③CaCl₂
(2)C B 解析:
(1)①一个硫酸根离子带两个单位负电荷,标注在右上角;②由图可知,钾原子质子数为19,形成钾离子时,质子数不变;③氯元素为-1价,钙元素为+2价,根据化合物中各元素正负化合价代数和为0可知氯化钙的化学式为CaCl₂。
(2)“●●”表示两个氢原子,氢气是双原子分子,故“●● ●●”表示两个氢分子,用符号分别表示为2H和2H₂。
(1)①SO₄²⁻ ②19 ③CaCl₂
(2)C B 解析:
(1)①一个硫酸根离子带两个单位负电荷,标注在右上角;②由图可知,钾原子质子数为19,形成钾离子时,质子数不变;③氯元素为-1价,钙元素为+2价,根据化合物中各元素正负化合价代数和为0可知氯化钙的化学式为CaCl₂。
(2)“●●”表示两个氢原子,氢气是双原子分子,故“●● ●●”表示两个氢分子,用符号分别表示为2H和2H₂。
19.2023全球6G技术大会3月22日在南京召开。硅(Si)是制作芯片不可缺少的材料,在元素周期表中的信息及原子结构示意图如图1所示,请结合图2回答下列问题。
 (1)硅原子的相对原子质量是
(1)硅原子的相对原子质量是
(2)C粒子属于
(3)图2中与硅元素化学性质相似的是
(4)硅元素与B所对应的元素形成化合物的化学式是
 (1)硅原子的相对原子质量是
(1)硅原子的相对原子质量是28.09
。(2)C粒子属于
阴离子
。(3)图2中与硅元素化学性质相似的是
A
。(4)硅元素与B所对应的元素形成化合物的化学式是
SiO₂
。
答案:
(1)28.09
(2)阴离子
(3)A
(4)SiO₂ 解析:
(2)C粒子核外电子数为2+8+8=18>核内质子数17,所以属于阴离子。
(3)元素化学性质取决于原子的最外层电子数,所以图2中与硅元素化学性质相似的是A,它们的最外层电子数都是4。
(4)硅元素显+4价,B为8号氧元素,氧元素显-2价,所以硅元素与氧元素所形成的化合物为二氧化硅,对应的化学式是SiO₂。
(1)28.09
(2)阴离子
(3)A
(4)SiO₂ 解析:
(2)C粒子核外电子数为2+8+8=18>核内质子数17,所以属于阴离子。
(3)元素化学性质取决于原子的最外层电子数,所以图2中与硅元素化学性质相似的是A,它们的最外层电子数都是4。
(4)硅元素显+4价,B为8号氧元素,氧元素显-2价,所以硅元素与氧元素所形成的化合物为二氧化硅,对应的化学式是SiO₂。
20.(2025·无锡期中)神舟十七号运载火箭使用的推进剂为偏二甲肼$(C_2H_8N_2)$和四氧化二氮$(N_2O_4)$的组合,两者都含有氮元素,如图是氮元素的价类二维图:
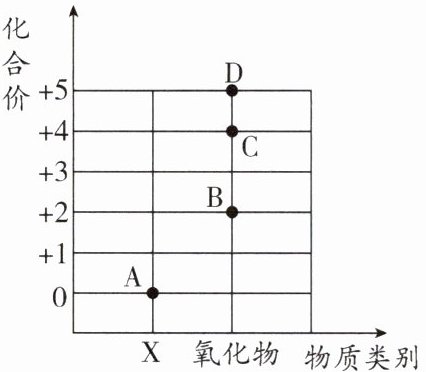
(1)四氧化二氮对应图中
(2)横坐标上对应的物质类别X是
(3)写出物质D的化学式:
(4)B、C、D三种物质的组成元素相同,但化学性质不同的原因是

(1)四氧化二氮对应图中
C
(填字母)。(2)横坐标上对应的物质类别X是
单质
。(3)写出物质D的化学式:
N₂O₅
。(4)B、C、D三种物质的组成元素相同,但化学性质不同的原因是
分子构成不同
。
答案:
(1)C
(2)单质
(3)N₂O₅
(4)分子构成不同 解析:
(1)设化合物中N元素的化合价为x,依据化合物中各元素正负化合价代数和为0,有x×2+(-2)×4=0,解得x=+4。
(2)X中氮元素化合价为0,所以X为单质。
(3)D为氧化物,氮元素化合价为+5,氧元素化合价为-2,则化学式为N₂O₅。
(4)同种分子化学性质相同,不同种分子化学性质不同,B、C、D三种物质的组成元素相同,但分子构成不同,所以化学性质不同。
(1)C
(2)单质
(3)N₂O₅
(4)分子构成不同 解析:
(1)设化合物中N元素的化合价为x,依据化合物中各元素正负化合价代数和为0,有x×2+(-2)×4=0,解得x=+4。
(2)X中氮元素化合价为0,所以X为单质。
(3)D为氧化物,氮元素化合价为+5,氧元素化合价为-2,则化学式为N₂O₅。
(4)同种分子化学性质相同,不同种分子化学性质不同,B、C、D三种物质的组成元素相同,但分子构成不同,所以化学性质不同。
21.我们周围的物质世界是由100多种元素组成的,为了便于研究元素的性质,常常需要寻找它们之间的内在规律。下表列出的是1~18号元素的部分最高正化合价和最低负化合价。请阅读并回答下列问题:
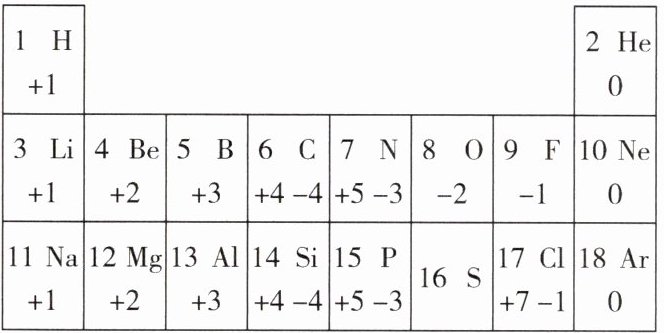
(1)11号元素属于
(2)16号元素的原子核外电子数为
(3)从化合价角度分析,我们可以发现一些规律。请写出其中的一个:

(1)11号元素属于
金属
(填“金属”或“非金属”)元素,它在化学反应中形成的离子与Ne
(填化学符号)原子具有相同的核外电子排布。(2)16号元素的原子核外电子数为
16
,推测该元素最低负化合价为-2
,最高正化合价的氧化物的化学式为SO₃
。(3)从化合价角度分析,我们可以发现一些规律。请写出其中的一个:
|最低负化合价|=8-最外层电子数(合理即可)
。
答案:
(1)金属 Ne
(2)16 -2 SO₃
(3)|最低负化合价|=8-最外层电子数(合理即可)
(1)金属 Ne
(2)16 -2 SO₃
(3)|最低负化合价|=8-最外层电子数(合理即可)
查看更多完整答案,请扫码查看


