第41页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
16.做电解水实验时,为了增强水的导电性,常在水中加入少量的氢氧化钠溶液。某同学配制了100 g含水量为99%的NaOH溶液,将其全部装入水电解器,通入直流电一段时间后,取出里面部分溶液进行测定,测得NaOH溶液含水量已变为98%。则该实验过程中,电解了多少克水?
答案:
解:设电解水的质量为 x,则:$\frac{100\,\text{g}× (1-99\%)}{100\,\text{g}-x}× 100\%=1-98\%$ 解得 x=50 g
答:电解了 50 g 水。
答:电解了 50 g 水。
17.现有100 g溶质质量分数为15%的硝酸钾溶液,欲使其溶质质量分数提高到30%,试计算,当分别采取下列措施时:
(1)需向此溶液中加入多少克硝酸钾?
(2)需蒸发掉多少克水?
(3)需向此溶液中加入溶质质量分数为50%的硝酸钾溶液多少克?
(1)需向此溶液中加入多少克硝酸钾?
(2)需蒸发掉多少克水?
(3)需向此溶液中加入溶质质量分数为50%的硝酸钾溶液多少克?
答案:
(1)解:设加入硝酸钾的质量为 x,则$\frac{100\,\text{g}× 15\%+x}{100\,\text{g}+x}× 100\%=30\%$,解得 x≈21.4 g。
(2)设蒸发水的质量为 y,则$\frac{100\,\text{g}× 15\%}{100\,\text{g}-y}× 100\%=30\%$,解得 y=50 g。
(3)设加入溶质质量分数为 50%的硝酸钾溶液质量为 k,则$\frac{100\,\text{g}× 15\%+k× 50\%}{100\,\text{g}+k}× 100\%=30\%$,解得 k=75 g。
答:
(1)需向此溶液中加入 21.4 g 硝酸钾。
(2)需蒸发掉50 g 水。
(3)需向此溶液中加入溶质质量分数为 50%的硝酸钾溶液 75 g。
(2)设蒸发水的质量为 y,则$\frac{100\,\text{g}× 15\%}{100\,\text{g}-y}× 100\%=30\%$,解得 y=50 g。
(3)设加入溶质质量分数为 50%的硝酸钾溶液质量为 k,则$\frac{100\,\text{g}× 15\%+k× 50\%}{100\,\text{g}+k}× 100\%=30\%$,解得 k=75 g。
答:
(1)需向此溶液中加入 21.4 g 硝酸钾。
(2)需蒸发掉50 g 水。
(3)需向此溶液中加入溶质质量分数为 50%的硝酸钾溶液 75 g。
18.(2024·青岛月考节选)在25℃下,实验室欲配制50 g质量分数为25%的$KNO_3$溶液,试回答下列问题。
(1)需要纯净的$KNO_3$
(2)某同学进行溶液配制时发生了下图的错误操作,该操作导致最后的溶质质量分数为

(3)下图是$KNO_3$饱和溶液溶质质量分数随温度变化的曲线,若要使60 g质量分数为30%的$KNO_3$溶液变为37.5%,采用的方法可以是
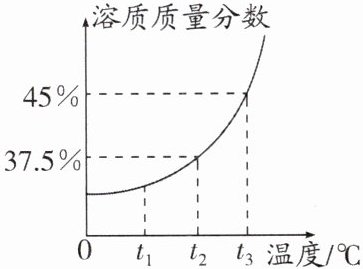
$A. t_2℃$时,恒温蒸发掉12 g水
$B. t_2℃$时,恒温蒸发掉原溶液中溶剂的一半
$C. t_2℃$时,加入$7.2 g KNO_3$粉末搅拌
$D. t_3℃$时,加入60 g质量分数为45%的$KNO_3$溶液
(1)需要纯净的$KNO_3$
12.5
g,需要量取37.5
mL水(水的密度:1 g/mL)。(2)某同学进行溶液配制时发生了下图的错误操作,该操作导致最后的溶质质量分数为
16.7
%(答案保留一位小数)。
(3)下图是$KNO_3$饱和溶液溶质质量分数随温度变化的曲线,若要使60 g质量分数为30%的$KNO_3$溶液变为37.5%,采用的方法可以是
ABCD
(填字母)。
$A. t_2℃$时,恒温蒸发掉12 g水
$B. t_2℃$时,恒温蒸发掉原溶液中溶剂的一半
$C. t_2℃$时,加入$7.2 g KNO_3$粉末搅拌
$D. t_3℃$时,加入60 g质量分数为45%的$KNO_3$溶液
答案:
(1)12.5 37.5 (2)16.7 (3)ABCD
解析:
(1)配制 50 g 质量分数为 25%的 KNO₃溶液,需要纯净的 KNO₃:50 g×25%=12.5 g,需要量取水(50 g-12.5 g)÷1 g/mL=37.5 mL。
(2)若其他操作都正确,错误操作导致最后的溶质质量分数为$\frac{7.5\,\text{g}}{7.5\,\text{g}+37.5\,\text{g}}× 100\%\approx 16.7\%$。
(3)$t_{2}\;^{\circ}\text{C}$时,恒温蒸发掉 12 g 水,所得溶液的溶质质量分数为$\frac{60\,\text{g}× 30\%}{60\,\text{g}-12\,\text{g}}× 100\%=37.5\%$,A 正确;$t_{2}\;^{\circ}\text{C}$时,恒温蒸发掉原溶液中溶剂质量的一半,所得溶液的溶质质量分数为$\frac{60\,\text{g}× 30\%}{60\,\text{g}-[60\,\text{g}-(60\,\text{g}× 30\%)]× 0.5}× 100\%\approx 46.2\%$,大于该温度下饱和溶液的溶质质量分数,应有晶体析出,溶质质量分数为 37.5%,B 正确;$t_{2}\;^{\circ}\text{C}$时加入 7.2 g KNO₃粉末,所得溶液的溶质质量分数是$\frac{60\,\text{g}× 30\%+7.2\,\text{g}}{60\,\text{g}+7.2\,\text{g}}× 100\%=37.5\%$,C 正确;60 g 质量分数为 30%的 KNO₃溶液与 60 g质量分数为 45%的 KNO₃溶液混合,所得溶液的溶质质量分数为$\frac{60\,\text{g}× 30\%+60\,\text{g}× 45\%}{120\,\text{g}}× 100\%=37.5\%$,D 正确。故选 ABCD。
解析:
(1)配制 50 g 质量分数为 25%的 KNO₃溶液,需要纯净的 KNO₃:50 g×25%=12.5 g,需要量取水(50 g-12.5 g)÷1 g/mL=37.5 mL。
(2)若其他操作都正确,错误操作导致最后的溶质质量分数为$\frac{7.5\,\text{g}}{7.5\,\text{g}+37.5\,\text{g}}× 100\%\approx 16.7\%$。
(3)$t_{2}\;^{\circ}\text{C}$时,恒温蒸发掉 12 g 水,所得溶液的溶质质量分数为$\frac{60\,\text{g}× 30\%}{60\,\text{g}-12\,\text{g}}× 100\%=37.5\%$,A 正确;$t_{2}\;^{\circ}\text{C}$时,恒温蒸发掉原溶液中溶剂质量的一半,所得溶液的溶质质量分数为$\frac{60\,\text{g}× 30\%}{60\,\text{g}-[60\,\text{g}-(60\,\text{g}× 30\%)]× 0.5}× 100\%\approx 46.2\%$,大于该温度下饱和溶液的溶质质量分数,应有晶体析出,溶质质量分数为 37.5%,B 正确;$t_{2}\;^{\circ}\text{C}$时加入 7.2 g KNO₃粉末,所得溶液的溶质质量分数是$\frac{60\,\text{g}× 30\%+7.2\,\text{g}}{60\,\text{g}+7.2\,\text{g}}× 100\%=37.5\%$,C 正确;60 g 质量分数为 30%的 KNO₃溶液与 60 g质量分数为 45%的 KNO₃溶液混合,所得溶液的溶质质量分数为$\frac{60\,\text{g}× 30\%+60\,\text{g}× 45\%}{120\,\text{g}}× 100\%=37.5\%$,D 正确。故选 ABCD。
19.配制1000 mL 20%的稀硫酸(密度为1.14 g/mL),需要98%的浓硫酸(密度为1.84 g/mL)多少毫升?需要水多少毫升?(结果精确到0.1)
答案:
解:设需要 98%的浓硫酸(密度为 1.84 g/mL)的体积为 x,则 1.84 g/mL×x×98%=1.14 g/mL×1000 mL×20%x≈126.4 mL
所需水的质量为 1.14 g/mL×1000 mL-1.84 g/mL×126.4 mL≈907.4 g
所需水的体积为 907.4 g÷1 g/mL=907.4 mL
答:需要 98%的浓硫酸和水分别是 126.4 mL、907.4 mL。
所需水的质量为 1.14 g/mL×1000 mL-1.84 g/mL×126.4 mL≈907.4 g
所需水的体积为 907.4 g÷1 g/mL=907.4 mL
答:需要 98%的浓硫酸和水分别是 126.4 mL、907.4 mL。
查看更多完整答案,请扫码查看


