第97页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
9. 纳米铁粉在空气中不易自燃,但稍加热即可剧烈燃烧,如图是纳米铁粉在锥形瓶中燃烧的实验。下列说法不正确的是( )
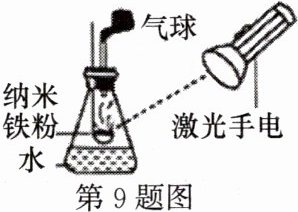
A.纳米铁粉燃烧的化学方程式为$3Fe + 2O_{2}\xlongequal{点燃}Fe_{3}O_{4}$
B.气球先膨胀后又变小
C.激光手电照射使纳米铁粉的着火点降低
D.锥形瓶中的水可防止生成物溅落炸裂瓶底

A.纳米铁粉燃烧的化学方程式为$3Fe + 2O_{2}\xlongequal{点燃}Fe_{3}O_{4}$
B.气球先膨胀后又变小
C.激光手电照射使纳米铁粉的着火点降低
D.锥形瓶中的水可防止生成物溅落炸裂瓶底
答案:
C
10. 向盛有$a g$铜锌混合物的烧杯中加入稀硫酸,该过程中剩余固体与加入稀硫酸的质量关系如图所示。下列说法错误的是( )
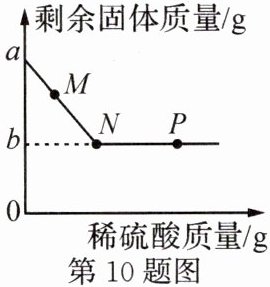
A.$M$点时,溶液中的溶质只有$ZnSO_{4}$
B.$N$点时,生成气体的总质量达到最大
C.$N\to P$过程中,溶液的$pH$逐渐增大
D.该铜锌混合物中锌的质量为$(a - b)g$

A.$M$点时,溶液中的溶质只有$ZnSO_{4}$
B.$N$点时,生成气体的总质量达到最大
C.$N\to P$过程中,溶液的$pH$逐渐增大
D.该铜锌混合物中锌的质量为$(a - b)g$
答案:
C
11. 金属在生活、生产中有着广泛的应用,金属材料已成为社会发展的重要物质基础。
(1)我国“天问一号”火星探测器成功降落火星,实现了中国航天史无前例的突破。在探测器运行系统中使用了铜丝作电线,是因为铜具有良好的______性和延展性。
(2)第24届冬奥会纪念币的材质为黄铜合金,强度高,耐腐蚀。若将少量黄铜合金投入到足量稀盐酸中,______(填“有”或“没有”)固体剩余。
(3)“嫦娥五号”使用的记忆合金再次让全世界关注新合金材料。$Mg_{2}Cu$是一种能够储存氢能源的合金,它吸氢后生成$MgCu_{2}合金和MgH_{2}$,而$MgH_{2}$和稀盐酸反应能产生氢气。$MgH_{2}和HCl$反应的化学方程式是______。
(1)我国“天问一号”火星探测器成功降落火星,实现了中国航天史无前例的突破。在探测器运行系统中使用了铜丝作电线,是因为铜具有良好的______性和延展性。
(2)第24届冬奥会纪念币的材质为黄铜合金,强度高,耐腐蚀。若将少量黄铜合金投入到足量稀盐酸中,______(填“有”或“没有”)固体剩余。
(3)“嫦娥五号”使用的记忆合金再次让全世界关注新合金材料。$Mg_{2}Cu$是一种能够储存氢能源的合金,它吸氢后生成$MgCu_{2}合金和MgH_{2}$,而$MgH_{2}$和稀盐酸反应能产生氢气。$MgH_{2}和HCl$反应的化学方程式是______。
答案:
(1)导电
(2)有
(3)MgH₂ + 2HCl = MgCl₂ + 2H₂↑
(1)导电
(2)有
(3)MgH₂ + 2HCl = MgCl₂ + 2H₂↑
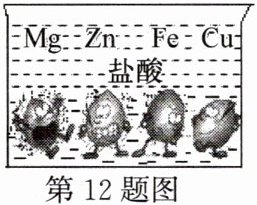
12. 如图是取大小形状相同的$Mg$、$Zn$、$Fe$、$Cu$四种金属与相同浓度的稀盐酸反应状况的示意图。仔细观察并结合所学的知识回答下列问题:
(1)不能与稀盐酸反应的金属是______。
(2)图中显示有三种金属能与稀盐酸反应,其共同的反应现象是______,其中反应速率最快的是______,请写出它与盐酸反应的化学方程式:______。
(3)通过以上实验(或图示)说明,$Zn和Cu$的金属活动性强弱是______。
(4)某兴趣小组的同学为了探究哪些因素可以影响金属与酸溶液反应的速率设计并进行了如下实验:
通过上述实验,小组同学得出了影响金属与酸溶液反应的速率的因素有很多,请你写出其中的一种:______。此外同学们提出影响金属与酸溶液反应的速率的因素还可能有温度,温度越高,反应速率越______(填“快”或“慢”)。
(1)不能与稀盐酸反应的金属是______。
(2)图中显示有三种金属能与稀盐酸反应,其共同的反应现象是______,其中反应速率最快的是______,请写出它与盐酸反应的化学方程式:______。
(3)通过以上实验(或图示)说明,$Zn和Cu$的金属活动性强弱是______。
(4)某兴趣小组的同学为了探究哪些因素可以影响金属与酸溶液反应的速率设计并进行了如下实验:
通过上述实验,小组同学得出了影响金属与酸溶液反应的速率的因素有很多,请你写出其中的一种:______。此外同学们提出影响金属与酸溶液反应的速率的因素还可能有温度,温度越高,反应速率越______(填“快”或“慢”)。

答案:
(1)铜
(2)有气泡产生 镁 Mg + 2HCl = MgCl₂ + H₂↑
(3)锌大于铜
(4)盐酸 铁粉 快 金属的性质或种类(或酸的浓度,或反应物的接触面积) 快
(1)铜
(2)有气泡产生 镁 Mg + 2HCl = MgCl₂ + H₂↑
(3)锌大于铜
(4)盐酸 铁粉 快 金属的性质或种类(或酸的浓度,或反应物的接触面积) 快
13. 实验小组在实验室找到一瓶含有铜和铁的均匀混合物。为测定该混合物中铁的质量分数,分别取一定质量的混合物与稀硫酸进行反应,实验分四组,所得数据如下表所示:
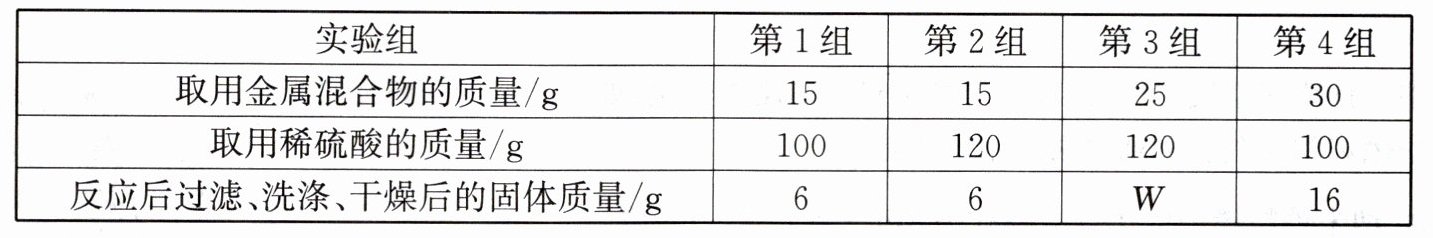
请分析数据,回答下列问题:
(1)该混合物中铁的质量分数为多少?
(2)表中的$W= $______(填数值)。
(3)第1组实验中所得滤液中的溶质是______(用化学式表示)。
(4)计算第4组实验中所得溶液溶质的质量分数。(写出计算过程,结果精确到$0.1\%$)

请分析数据,回答下列问题:
(1)该混合物中铁的质量分数为多少?
(2)表中的$W= $______(填数值)。
(3)第1组实验中所得滤液中的溶质是______(用化学式表示)。
(4)计算第4组实验中所得溶液溶质的质量分数。(写出计算过程,结果精确到$0.1\%$)
答案:
(1)比较第1组、第2组可知:15g混合物中的铁已完全反应,铁为9g,铜为6g;按组成比例,30g混合物中铁有18g、铜有12g;Fe% = $\frac{9g}{15g}$ × 100% = 60%。
(2)10
(3)FeSO₄、H₂SO₄
(4)设生成硫酸亚铁质量为x,生成氢气质量为y。Fe + H₂SO₄ = FeSO₄ + H₂↑56 152 2 14g x y x = 38g,y = 0.5g FeSO₄% = $\frac{38g}{100g + 14g - 0.5g}$ × 100% ≈ 33.5%
(1)比较第1组、第2组可知:15g混合物中的铁已完全反应,铁为9g,铜为6g;按组成比例,30g混合物中铁有18g、铜有12g;Fe% = $\frac{9g}{15g}$ × 100% = 60%。
(2)10
(3)FeSO₄、H₂SO₄
(4)设生成硫酸亚铁质量为x,生成氢气质量为y。Fe + H₂SO₄ = FeSO₄ + H₂↑56 152 2 14g x y x = 38g,y = 0.5g FeSO₄% = $\frac{38g}{100g + 14g - 0.5g}$ × 100% ≈ 33.5%
查看更多完整答案,请扫码查看


