第103页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
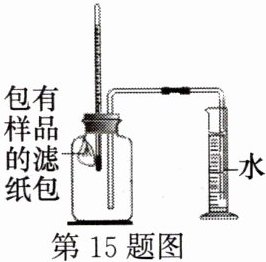
15. 世界上每年因锈蚀而报废的金属设备和材料,高达产量的$20 \% \sim 40 \%$。某实验小组用如图装置对铁锈蚀的条件进行探究:将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧。不久,观察到量筒内水沿着细导管慢慢进入容积为$154 \mathrm { mL }$的广口瓶中。当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零)。
记录起始和最终量筒的读数以及所需时间如下表:
|序号|样品|量筒起始读数/mL|量筒最终读数/mL|所需时间/min|
|①|$1 \mathrm { g }$铁粉、$0.2 \mathrm { g }碳和10$滴水|$100$|$71$|约$120$|
|②|$1 \mathrm { g }$铁粉、$0.2 \mathrm { g }$碳、$10滴水和少量\mathrm { NaCl }$|$100$|$71$|约$70$|
|③|______|$\setminus$|$\setminus$|$\setminus$|
(1) 实验①和②说明$\mathrm { NaCl }$可以______(填“加快”或“减慢”)铁锈蚀的速率。
(2) 实验①和③是探究碳对铁锈蚀速率的影响,实验③的样品组成是______。
(3) 该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是______$\%$(结果保留到$0.1 \%$),试分析该实验结果出现误差的原因:______。
记录起始和最终量筒的读数以及所需时间如下表:
|序号|样品|量筒起始读数/mL|量筒最终读数/mL|所需时间/min|
|①|$1 \mathrm { g }$铁粉、$0.2 \mathrm { g }碳和10$滴水|$100$|$71$|约$120$|
|②|$1 \mathrm { g }$铁粉、$0.2 \mathrm { g }$碳、$10滴水和少量\mathrm { NaCl }$|$100$|$71$|约$70$|
|③|______|$\setminus$|$\setminus$|$\setminus$|
(1) 实验①和②说明$\mathrm { NaCl }$可以______(填“加快”或“减慢”)铁锈蚀的速率。
(2) 实验①和③是探究碳对铁锈蚀速率的影响,实验③的样品组成是______。
(3) 该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是______$\%$(结果保留到$0.1 \%$),试分析该实验结果出现误差的原因:______。

答案:
(1)加快
(2)1g 铁粉、10 滴水
(3)19.2 滤纸包占有一定体积
(1)加快
(2)1g 铁粉、10 滴水
(3)19.2 滤纸包占有一定体积
16. 往$200 \mathrm { g } \mathrm { FeCl } _ { 3 }和\mathrm { CuCl } _ { 2 }$的混合溶液中加入铁粉。已知反应的先后顺序和化学方程式分别为:$$2 \mathrm { FeCl } _ { 3 } + \mathrm { Fe } = 3 \mathrm { FeCl } _ { 2 }$$;$$\mathrm { CuCl } _ { 2 } + \mathrm { Fe } = \mathrm { FeCl } _ { 2 } + \mathrm { Cu }$$。如图为加入铁粉的质量与反应后剩余固体质量的关系。下列有关说法不正确的是 ( )
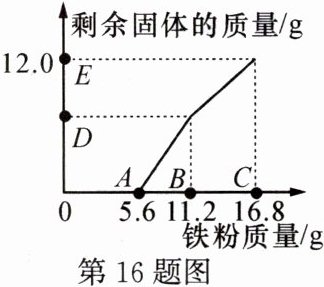
A.$B$点后溶液的颜色为蓝色
B.$D点对应纵坐标为6.4$
C.该$200 \mathrm { g }溶液中的\mathrm { CuCl } _ { 2 }质量分数为6.75 \%$
D.取$DE$两点间的剩余固体加入盐酸,均有气泡产生

A.$B$点后溶液的颜色为蓝色
B.$D点对应纵坐标为6.4$
C.该$200 \mathrm { g }溶液中的\mathrm { CuCl } _ { 2 }质量分数为6.75 \%$
D.取$DE$两点间的剩余固体加入盐酸,均有气泡产生
答案:
A
17. 某兴趣小组的同学为测定铜铁合金粉末中铜的质量分数,先称得两份质量均为$m \mathrm { g }$的合金粉末,然后甲、乙两名同学分别按以下两种方案进行实验:
甲同学方案:合金粉末$\xrightarrow [ \text { 充分反应 } ] { \text { 加入过量稀硫酸 } }$过滤,将得到固体洗涤、干燥、称量,称得质量为$a \mathrm { g }$。
乙同学方案:合金粉末$\xrightarrow [ \text { 充分反应 } ] { \text { 加入过量的硫酸铜溶液 } }$过滤,将得到的固体洗涤、干燥、称量,称得质量为$b \mathrm { g }$。
请回答下列问题:
(1) 甲同学方案中,反应开始发生时的明显现象是______。
(2) 实验结束后,甲同学计算出合金中铜的质量分数为:$\frac { a } { m } × 100 \%$;乙同学计算出合金中铜的质量分数为:$\frac { b } { m } × 100 \%$。经过同学们讨论,一致认为______同学的计算结果是错误的,原因是______。
甲同学方案:合金粉末$\xrightarrow [ \text { 充分反应 } ] { \text { 加入过量稀硫酸 } }$过滤,将得到固体洗涤、干燥、称量,称得质量为$a \mathrm { g }$。
乙同学方案:合金粉末$\xrightarrow [ \text { 充分反应 } ] { \text { 加入过量的硫酸铜溶液 } }$过滤,将得到的固体洗涤、干燥、称量,称得质量为$b \mathrm { g }$。
请回答下列问题:
(1) 甲同学方案中,反应开始发生时的明显现象是______。
(2) 实验结束后,甲同学计算出合金中铜的质量分数为:$\frac { a } { m } × 100 \%$;乙同学计算出合金中铜的质量分数为:$\frac { b } { m } × 100 \%$。经过同学们讨论,一致认为______同学的计算结果是错误的,原因是______。
答案:
(1)有气泡产生
(2)乙 称得固体中既有原混合物中的铜,还有新生成的铜
(1)有气泡产生
(2)乙 称得固体中既有原混合物中的铜,还有新生成的铜
查看更多完整答案,请扫码查看


