第17页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
7.探究铁的冶炼原理的实验装置和炼铁高炉的示意图如下,下列叙述正确的是 ( )

A.甲图中实验结束时,应先停止通一氧化碳再熄灭酒精喷灯
B.乙图中高炉炼铁的原料中焦炭的作用只是利用其燃烧提供热量
C.乙图中为了使焦炭燃烧生成一氧化碳,只需通入少量的热空气
D.完全反应后,甲、乙图中得到产物的区别是甲图得到的是纯净物,乙图得到的是混合物

A.甲图中实验结束时,应先停止通一氧化碳再熄灭酒精喷灯
B.乙图中高炉炼铁的原料中焦炭的作用只是利用其燃烧提供热量
C.乙图中为了使焦炭燃烧生成一氧化碳,只需通入少量的热空气
D.完全反应后,甲、乙图中得到产物的区别是甲图得到的是纯净物,乙图得到的是混合物
答案:
D
8.某工厂要用赤铁矿石(假设杂质不含铁元素)来炼制生铁。若要炼制含铁96%的生铁70 t,则理论上需要含杂质20%的赤铁矿石的质量是(在炼制过程中赤铁矿的损耗率达20%)( )
A.120 t
B.108 t
C.96 t
D.150 t
A.120 t
B.108 t
C.96 t
D.150 t
答案:
D
9.我国有着悠久的钢铁冶炼史,“炒钢法”生产钢铁的过程如图。(潮泥灰的主要成分是石灰石)
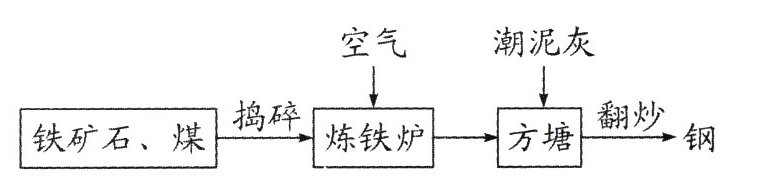
根据图文回答下列问题。
(1)常见的铁矿石有赤铁矿和__________(写一种)。
(2)不断鼓入空气的目的是____________。
(3)炼铁炉中生成铁的化学方程式为______________________________。
(4)撒入潮泥灰的主要作用是________。不断翻炒液态生铁,是为了降低______元素的含量。
(5)钢的性能优良,如钢的熔点比纯铁的______,易于加工。

根据图文回答下列问题。
(1)常见的铁矿石有赤铁矿和__________(写一种)。
(2)不断鼓入空气的目的是____________。
(3)炼铁炉中生成铁的化学方程式为______________________________。
(4)撒入潮泥灰的主要作用是________。不断翻炒液态生铁,是为了降低______元素的含量。
(5)钢的性能优良,如钢的熔点比纯铁的______,易于加工。
答案:
磁铁矿(合理均可)@@提高炉温@@Fe₂O₃ + 3CO$\stackrel{高温}{=\!=\!=}$2Fe + 3CO₂@@除杂@@碳@@低
10.我国古代科技璀璨夺目,金属的冶炼与使用在当时已处于世界先进水平。
(1)日常生活中,适合制作电缆的金属是______(填字母)。
A.金 B.铜 C.汞 D.钨
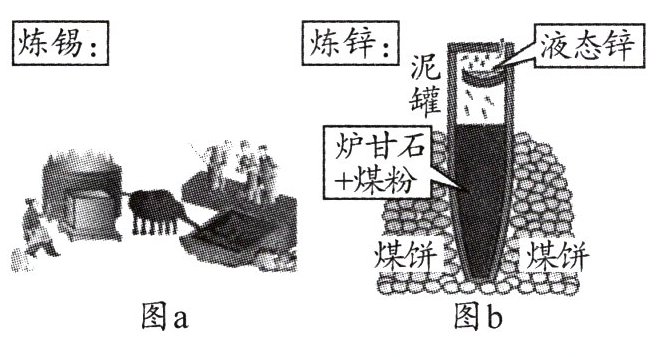
(2)明代《天工开物》描述了锡的冶炼方法,如图a。
①原料锡砂中的SnO₂和木炭反应得到锡和二氧化碳,化学方程式为______________________________。
②炼锡时混入少许铅形成合金,产物更易熔化流出,原因是____________________。
(3)图b为古代炼锌工艺原理示意图。炉甘石成分是ZnCO₃,高温易分解生成ZnO。
①泥罐外煤饼的主要作用是燃烧提供热量,泥罐内煤粉的主要作用是__________。
②已知锌的沸点为907 ℃,泥罐下部温度可达1 200 ℃,上部约为600 ℃,该工艺从混合物中收集液态锌的方法属于______(填字母)。
A.结晶 B.蒸发 C.蒸馏 D.升华
③必须冷却后才能取锌,是为了防止发生反应:______________________________(用化学方程式表示)。
(4)湿法冶金利用置换反应。向Cu(NO₃)₂、AgNO₃混合液中加入Fe粉,充分反应后过滤。若滤渣中有两种金属,则滤液中一定不含的金属阳离子是________。
(1)日常生活中,适合制作电缆的金属是______(填字母)。
A.金 B.铜 C.汞 D.钨
(2)明代《天工开物》描述了锡的冶炼方法,如图a。
①原料锡砂中的SnO₂和木炭反应得到锡和二氧化碳,化学方程式为______________________________。
②炼锡时混入少许铅形成合金,产物更易熔化流出,原因是____________________。
(3)图b为古代炼锌工艺原理示意图。炉甘石成分是ZnCO₃,高温易分解生成ZnO。
①泥罐外煤饼的主要作用是燃烧提供热量,泥罐内煤粉的主要作用是__________。
②已知锌的沸点为907 ℃,泥罐下部温度可达1 200 ℃,上部约为600 ℃,该工艺从混合物中收集液态锌的方法属于______(填字母)。
A.结晶 B.蒸发 C.蒸馏 D.升华
③必须冷却后才能取锌,是为了防止发生反应:______________________________(用化学方程式表示)。
(4)湿法冶金利用置换反应。向Cu(NO₃)₂、AgNO₃混合液中加入Fe粉,充分反应后过滤。若滤渣中有两种金属,则滤液中一定不含的金属阳离子是________。

答案:
B@@C + SnO₂$\stackrel{高温}{=\!=\!=}$Sn + CO₂↑@@形成合金,熔点降低@@作还原剂@@C@@2Zn + O₂$\stackrel{高温}{=\!=\!=}$2ZnO@@Ag⁺
查看更多完整答案,请扫码查看


