第57页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
4. (2024 辽宁) 为实现氢氧化钠溶液和盐酸反应现象的可视化,某兴趣小组设计如下实验。
[监测温度](1)在稀氢氧化钠溶液和稀盐酸反应过程中,温度传感器监测到溶液温度升高,说明该反应
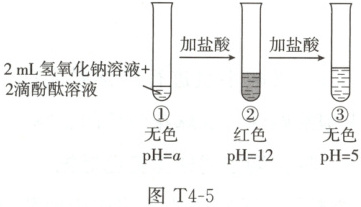
[观察颜色](2)在试管中加入$2\ mL$某浓度的氢氧化钠溶液,滴入$2$滴酚酞溶液作
(3)在①中未观察到预期的红色,为探明原因,小组同学查阅到酚酞变色范围如下:$0 < pH < 8.2$时呈无色,$8.2 < pH < 13$时呈红色,$ pH > 13$时呈无色。
据此推断,①中$a$的取值范围是
A.$0 < a < 8.2$
B.$8.2 < a < 13$
C.$a > 13$
(4)一段时间后,重复(2)实验,观察到滴加盐酸的过程中有少量气泡生成,原因是
[观察沉淀](5)小组同学提出,可通过调控反应物浓度观察生成的氯化钠沉淀。向含$8\ g$溶质的浓氢氧化钠溶液中加入浓盐酸,恰好完全反应至中性,生成$ NaCl$的质量是
恢复至室温,称得混合物的总质量为$36.7\ g$,其中$ NaCl$沉淀的质量为
[多现象可视](6)如图 T4-6所示,注射器$1$、$3$中均为$8\ mL$氯化氢气体,注射器$2$、$4$中分别为$2\ mL$蒸馏水和稀氢氧化钠溶液(均滴有酚酞溶液)。打开弹簧夹,迅速将注射器$1$、$3$中全部氯化氢分别推入注射器$2$、$4$中,用弹簧夹夹紧乳胶管。最终发现注射器$2$、$4$的活塞均恢复至$2\ mL$刻度附近,此现象不足以
说明氯化氢与稀氢氧化钠溶液发生了反应,
理由是
始终澄清,为了说明中和反应已发生,还应依
据的现象为
。

[监测温度](1)在稀氢氧化钠溶液和稀盐酸反应过程中,温度传感器监测到溶液温度升高,说明该反应
放热
(填“吸热”或“放热”),化学方程式为HCl+NaOH═NaCl+H₂O
。[观察颜色](2)在试管中加入$2\ mL$某浓度的氢氧化钠溶液,滴入$2$滴酚酞溶液作
指示
剂,再逐滴加入盐酸,振荡,该过程中溶液的颜色和$ pH$记录如图 T4-5所示。
(3)在①中未观察到预期的红色,为探明原因,小组同学查阅到酚酞变色范围如下:$0 < pH < 8.2$时呈无色,$8.2 < pH < 13$时呈红色,$ pH > 13$时呈无色。
据此推断,①中$a$的取值范围是
C
(填字母)。A.$0 < a < 8.2$
B.$8.2 < a < 13$
C.$a > 13$
(4)一段时间后,重复(2)实验,观察到滴加盐酸的过程中有少量气泡生成,原因是
氢氧化钠变质生成碳酸钠,盐酸与碳酸钠发生反应(合理即可)
。[观察沉淀](5)小组同学提出,可通过调控反应物浓度观察生成的氯化钠沉淀。向含$8\ g$溶质的浓氢氧化钠溶液中加入浓盐酸,恰好完全反应至中性,生成$ NaCl$的质量是
11.7
$ g$;恢复至室温,称得混合物的总质量为$36.7\ g$,其中$ NaCl$沉淀的质量为
2.7
$ g$。(提示:室温下$100\ g$水最多能溶解$36\ g\ NaCl$。)[多现象可视](6)如图 T4-6所示,注射器$1$、$3$中均为$8\ mL$氯化氢气体,注射器$2$、$4$中分别为$2\ mL$蒸馏水和稀氢氧化钠溶液(均滴有酚酞溶液)。打开弹簧夹,迅速将注射器$1$、$3$中全部氯化氢分别推入注射器$2$、$4$中,用弹簧夹夹紧乳胶管。最终发现注射器$2$、$4$的活塞均恢复至$2\ mL$刻度附近,此现象不足以
说明氯化氢与稀氢氧化钠溶液发生了反应,
理由是
氯化氢溶于水也可导致注射器4的活塞恢复至2mL刻度附近(或注射器2中没有发生酸碱中和反应,且注射器2、4的活塞均恢复至2mL刻度附近,因此不足以说明注射器4中氯化氢与稀氢氧化钠溶液发生反应)
注射器2中溶液仍为无色,注射器4中溶液由红色变为无色(或反应后注射器4比注射器2温度高)
。若实验中溶液始终澄清,为了说明中和反应已发生,还应依
据的现象为
。

答案:
4.(1)放热 HCl+NaOH═NaCl+H₂O
(2)指示
(3)C
(4)氢氧化钠变质生成碳酸钠,盐酸与碳酸钠发生反应(合理即可)
(5)11.7 2.7
(6)氯化氢溶于水也可导致注射器4的活塞恢复至2mL刻度附近(或注射器2中没有发生酸碱中和反应,且注射器2、4的活塞均恢复至2mL刻度附近,因此不足以说明注射器4中氯化氢与稀氢氧化钠溶液发生反应) 注射器2中溶液仍为无色,注射器4中溶液由红色变为无色(或反应后注射器4比注射器2温度高)
(2)指示
(3)C
(4)氢氧化钠变质生成碳酸钠,盐酸与碳酸钠发生反应(合理即可)
(5)11.7 2.7
(6)氯化氢溶于水也可导致注射器4的活塞恢复至2mL刻度附近(或注射器2中没有发生酸碱中和反应,且注射器2、4的活塞均恢复至2mL刻度附近,因此不足以说明注射器4中氯化氢与稀氢氧化钠溶液发生反应) 注射器2中溶液仍为无色,注射器4中溶液由红色变为无色(或反应后注射器4比注射器2温度高)
查看更多完整答案,请扫码查看


