第11页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
(2025 河北)供氧自救器可用于生产、生活中遇到有害气体时应急自救,某兴趣小组探究并自制了供氧自救器。
活动一 探究供氧自救器
[分析原理] 为防止人体吸入有害气体,使用自救器时夹住鼻子,只用嘴呼吸,使气体在“气囊→人体→$CO_2$ 清洁罐→气囊”间形成循环(如图 K2-1 所示)。

[交流讨论]
(1) 用氧气瓶为人体提供氧气,是因为氧气能供给
(2) 氧气经压缩储存于氧气瓶中,从微观角度分析,氧气可被压缩是因为
(3)$CO_2$ 清洁罐中填充有$CO_2$ 吸收剂。小组同学讨论后认为:氢氧化钠和氢氧化钙均可吸收$CO_2$,理由是
活动二 自制简易供氧自救器
小组同学利用化学方法提供氧气,制作简易供氧自救器。
[回忆旧知]
(4) 获取氧气的化学方法:
一是加热高锰酸钾,反应的化学方程式为
二是混合过氧化氢溶液和二氧化锰,反应的化学方程式为$2H_2O_2 \stackrel{MnO_2}{=}2H_2O + O_2↑$。
小组同学经讨论选择了第二种方法。
[设计制作] 参照图 K2-1 所示原理,利用透明塑料板、导管等材料,设计并制作了如图 K2-2 所示的简易供氧自救器(鼻夹、排气阀等未画出)。
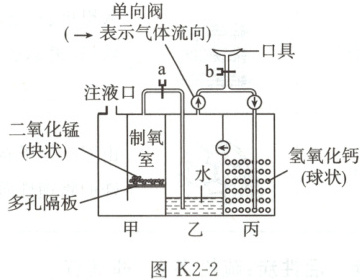
[分析讨论] 使用时,打开开关 a、b,从注液口加入适量过氧化氢溶液,自救器开始工作。
(5) 工作时,乙中水的作用是
(6) 关闭开关 a 可使制氧室中的反应基本停止,其原理是
[实践应用] 小组同学试用了自制的简易供氧自救器,效果很好。
[反思拓展]
(7) 供氧自救器需要科学维护,应定期检查:
活动一 探究供氧自救器
[分析原理] 为防止人体吸入有害气体,使用自救器时夹住鼻子,只用嘴呼吸,使气体在“气囊→人体→$CO_2$ 清洁罐→气囊”间形成循环(如图 K2-1 所示)。

[交流讨论]
(1) 用氧气瓶为人体提供氧气,是因为氧气能供给
呼吸
。(2) 氧气经压缩储存于氧气瓶中,从微观角度分析,氧气可被压缩是因为
分子之间有间隔,压缩时分子间隔减小
。(3)$CO_2$ 清洁罐中填充有$CO_2$ 吸收剂。小组同学讨论后认为:氢氧化钠和氢氧化钙均可吸收$CO_2$,理由是
氢氧化钠和氢氧化钙都能与二氧化碳发生化学反应
。资料显示:氢氧化钠比氢氧化钙价格高,且具有强烈的腐蚀性。故实际选用氢氧化钙作$CO_2$ 吸收剂。活动二 自制简易供氧自救器
小组同学利用化学方法提供氧气,制作简易供氧自救器。
[回忆旧知]
(4) 获取氧气的化学方法:
一是加热高锰酸钾,反应的化学方程式为
$2KMnO₄ \overset{\triangle}{=}K₂MnO₄ + MnO₂ + O₂↑$
;二是混合过氧化氢溶液和二氧化锰,反应的化学方程式为$2H_2O_2 \stackrel{MnO_2}{=}2H_2O + O_2↑$。
小组同学经讨论选择了第二种方法。
[设计制作] 参照图 K2-1 所示原理,利用透明塑料板、导管等材料,设计并制作了如图 K2-2 所示的简易供氧自救器(鼻夹、排气阀等未画出)。

[分析讨论] 使用时,打开开关 a、b,从注液口加入适量过氧化氢溶液,自救器开始工作。
(5) 工作时,乙中水的作用是
湿润氧气(或冷却氧气等,合理即可)
(写一条即可)。(6) 关闭开关 a 可使制氧室中的反应基本停止,其原理是
制氧室中压强增大,将液体逐渐压到隔板下方,固液分离,从而反应停止
。[实践应用] 小组同学试用了自制的简易供氧自救器,效果很好。
[反思拓展]
(7) 供氧自救器需要科学维护,应定期检查:
氧气瓶的气密性(或开关是否灵活等,合理即可)
(写一条即可)。
答案:
(1)呼吸
(2)分子之间有间隔,压缩时分子间隔减小
(3)氢氧化钠和氢氧化钙都能与二氧化碳发生化学反应$ (4)2KMnO₄ \overset{\triangle}{=}K₂MnO₄ + MnO₂ + O₂↑ (5)$湿润氧气(或冷却氧气等,合理即可)
(6)制氧室中压强增大,将液体逐渐压到隔板下方,固液分离,从而反应停止
(7)氧气瓶的气密性(或开关是否灵活等,合理即可)
(1)呼吸
(2)分子之间有间隔,压缩时分子间隔减小
(3)氢氧化钠和氢氧化钙都能与二氧化碳发生化学反应$ (4)2KMnO₄ \overset{\triangle}{=}K₂MnO₄ + MnO₂ + O₂↑ (5)$湿润氧气(或冷却氧气等,合理即可)
(6)制氧室中压强增大,将液体逐渐压到隔板下方,固液分离,从而反应停止
(7)氧气瓶的气密性(或开关是否灵活等,合理即可)
查看更多完整答案,请扫码查看


