第27页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
1. 溶质的质量分数
(1)定义:溶液中溶质的质量分数是
(2)公式
①溶质的质量分数=$\frac{ 溶质质量}{ 溶液质量}×100\%$(所有溶液均适用)。
②溶质的质量分数=$\frac{ 溶解度}{ 溶解度+100\ g}×100\%$(仅适用于饱和溶液)。
【注意】
①溶质的质量分数必须用百分数表示,不能用分数或小数表示。
②溶质质量指已溶解在溶剂里的溶质的质量,不一定等于加入的溶质质量(即没有溶解的部分不计入溶质质量)。
③一定温度下,某物质的饱和溶液的溶质质量分数是该温度下的最大值,且为定值。
④溶液是混合物,必须换算成溶质的质量代入化学方程式才能进行计算。
(1)定义:溶液中溶质的质量分数是
溶质
质量与溶液
质量之比。(2)公式
①溶质的质量分数=$\frac{ 溶质质量}{ 溶液质量}×100\%$(所有溶液均适用)。
②溶质的质量分数=$\frac{ 溶解度}{ 溶解度+100\ g}×100\%$(仅适用于饱和溶液)。
【注意】
①溶质的质量分数必须用百分数表示,不能用分数或小数表示。
②溶质质量指已溶解在溶剂里的溶质的质量,不一定等于加入的溶质质量(即没有溶解的部分不计入溶质质量)。
③一定温度下,某物质的饱和溶液的溶质质量分数是该温度下的最大值,且为定值。
④溶液是混合物,必须换算成溶质的质量代入化学方程式才能进行计算。
答案:
1.
(1)溶质 溶液
(1)溶质 溶液
2. 溶液的稀释
(1)依据:溶液稀释前后,
(2)公式:浓溶液质量×浓溶液溶质质量分数=稀溶液质量×稀溶液溶质质量分数。
(1)依据:溶液稀释前后,
溶质
的质量不变。(2)公式:浓溶液质量×浓溶液溶质质量分数=稀溶液质量×稀溶液溶质质量分数。
答案:
2.
(1)溶质
(1)溶质
易错辨析
(1)100 g 10%的硝酸钾溶液的含义是100 g水中含有10 g硝酸钾 (
(2)20℃时氯化钠的溶解度是36 g,则20℃时氯化钠饱和溶液的溶质质量分数小于36% (
(3)t℃,甲物质的溶解度是50 g。t℃,将30 g甲物质加入50 g水中,充分搅拌,所得溶液的溶质质量分数是37.5% (
(4)用50 g质量分数为19.6%的稀硫酸与足量锌粒充分反应,参加反应的硫酸质量是50 g (
(5)配制500 g溶质质量分数为0.9%的生理盐水,不需要使用蒸发皿 (
(6)配制50 g溶质质量分数为6%的氯化钠溶液,量取水的操作如图5-1所示,其他操作都正确,所配溶液中氯化钠的质量分数小于6% (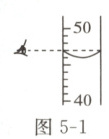
(7)利用海水在阳光下发生分解反应制得食盐 (
(8)蒸发食盐溶液时待水蒸干后停止加热 (
(9)在“粗盐中难溶性杂质的去除”的实验中,玻璃棒用了4次,但作用各不相同 (
(1)100 g 10%的硝酸钾溶液的含义是100 g水中含有10 g硝酸钾 (
×
)(2)20℃时氯化钠的溶解度是36 g,则20℃时氯化钠饱和溶液的溶质质量分数小于36% (
√
)(3)t℃,甲物质的溶解度是50 g。t℃,将30 g甲物质加入50 g水中,充分搅拌,所得溶液的溶质质量分数是37.5% (
×
)(4)用50 g质量分数为19.6%的稀硫酸与足量锌粒充分反应,参加反应的硫酸质量是50 g (
×
)(5)配制500 g溶质质量分数为0.9%的生理盐水,不需要使用蒸发皿 (
√
)(6)配制50 g溶质质量分数为6%的氯化钠溶液,量取水的操作如图5-1所示,其他操作都正确,所配溶液中氯化钠的质量分数小于6% (
×
)
(7)利用海水在阳光下发生分解反应制得食盐 (
×
)(8)蒸发食盐溶液时待水蒸干后停止加热 (
×
)(9)在“粗盐中难溶性杂质的去除”的实验中,玻璃棒用了4次,但作用各不相同 (
√
)
答案:
(1)×
(2)√
(3)×
(4)×
(5)√
(6)×
(7)×
(8)×
(9)√
(1)×
(2)√
(3)×
(4)×
(5)√
(6)×
(7)×
(8)×
(9)√
实验1 配制一定溶质质量分数的溶液
1. 仪器的选用及各仪器的作用
(1)所用仪器:天平(带砝码)、药匙(溶质为固体时)、
(2)玻璃棒的作用:搅拌,
(3)量筒的作用:量取一定体积的液体。选取量筒时量取液体的体积不能
2. 操作步骤
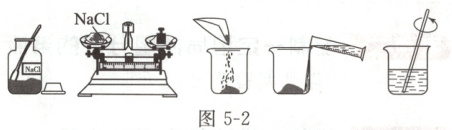
所配制溶液的溶质为固体(以氯化钠为例,如图5-2所示)。
(1)
(2)
(3)
(4)
(5)
3. 注意事项
(1)天平的使用:用天平称量时要遵循“
(2)量筒的使用
①用量筒量取液体,读数时视线应与量筒内液体
②所要量取液体的体积不能大于选取量筒的量程,且越接近越好。
4. 误差分析
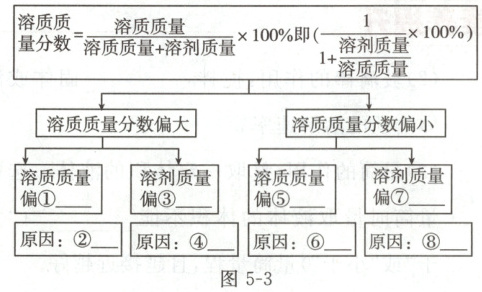
同学们对溶液配制的过程进行分析并构建了如图5-3所示造成偏差的思维模型,请补全模型并分析偏差产生的原因(原因分析从下列选项中选择,填字母)。
a. 所称取的氯化钠固体不纯
b. 砝码生锈或粘有污渍
c. 转移氯化钠时,称量纸上有少量残留
d. 用量筒量取水时,俯视液面
e. 向烧杯中倒水时,有少量的水洒出
f. 烧杯不干燥,内壁有水珠
1. 仪器的选用及各仪器的作用
(1)所用仪器:天平(带砝码)、药匙(溶质为固体时)、
量筒
、胶头滴管、烧杯
、玻璃棒等。(2)玻璃棒的作用:搅拌,
加快
固体或液体溶质的溶解速率。(3)量筒的作用:量取一定体积的液体。选取量筒时量取液体的体积不能
大于
(“大于”或“小于”)量筒量程,且越接近越好。2. 操作步骤
所配制溶液的溶质为固体(以氯化钠为例,如图5-2所示)。

(1)
计算
:计算所需氯化钠和水的质量。(2)
称量
:用天平称量所需质量的氯化钠,放入烧杯中。(3)
量取
:用量筒量取所需体积的水,倒入盛有氯化钠的烧杯中。(4)
溶解
:用玻璃棒搅拌,使氯化钠溶解。(5)
装瓶、贴标签
:将配制好的溶液装入试剂瓶中并贴上标签。3. 注意事项
(1)天平的使用:用天平称量时要遵循“
左物右码
”的原则,且左右两盘上要垫上相同的称量纸,有腐蚀性或易潮解的试剂应放在玻璃器皿中称量。(2)量筒的使用
①用量筒量取液体,读数时视线应与量筒内液体
凹液面的最低处
相平。②所要量取液体的体积不能大于选取量筒的量程,且越接近越好。
4. 误差分析
同学们对溶液配制的过程进行分析并构建了如图5-3所示造成偏差的思维模型,请补全模型并分析偏差产生的原因(原因分析从下列选项中选择,填字母)。

a. 所称取的氯化钠固体不纯
b. 砝码生锈或粘有污渍
c. 转移氯化钠时,称量纸上有少量残留
d. 用量筒量取水时,俯视液面
e. 向烧杯中倒水时,有少量的水洒出
f. 烧杯不干燥,内壁有水珠
答案:
1.
(1)量筒 烧杯
(2)加快
(3)大于
2.
(1)计算
(2)称量
(3)量取
(4)溶解
(5)装瓶、贴标签
3.
(1)左物右码
(2)①凹液面的最低处
4.①大 ②b ③小 ④de ⑤小 ⑥ac ⑦大 ⑧f
5.
(1)①计算 ②量取 ③混匀 ④装瓶、贴标签
(1)量筒 烧杯
(2)加快
(3)大于
2.
(1)计算
(2)称量
(3)量取
(4)溶解
(5)装瓶、贴标签
3.
(1)左物右码
(2)①凹液面的最低处
4.①大 ②b ③小 ④de ⑤小 ⑥ac ⑦大 ⑧f
5.
(1)①计算 ②量取 ③混匀 ④装瓶、贴标签
查看更多完整答案,请扫码查看


