2025年新教材新评估九年级化学全一册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年新教材新评估九年级化学全一册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第90页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
8. 为探究锌、铜、镍三种金属的性质,某兴趣小组进行了如下实验。
【实验一】取粗细、长短相同的锌丝、铜丝、镍丝均与 50 mL 稀盐酸反应,实验记录如下:
(1) 经查阅资料得知,镍与稀盐酸反应生成氯化镍(${NiCl_{2}}$)和氢气,则镍与稀盐酸反应的化学方程式是
(2) 小组同学分析得出,要判断三种金属的活动性强弱,必须在实验一的基础上增补一个实验才能得出结论,其实验内容为:另取一根粗细、长短相同的锌丝放入 50 mL 浓度为
(3) 实验时,有同学建议先用砂纸将三种金属丝表面进行打磨,目的是
【实验二】(4) 小组同学又设计了下表中的实验,成功地验证了三种金属的活动性强弱。
(4)
【拓展延伸】(5) 为了回收利用金属,同学们将实验一、实验二反应后的物质倒入同一容器中,向其中加入过量的铝粉,充分反应后过滤,则滤渣中的金属单质为
【实验一】取粗细、长短相同的锌丝、铜丝、镍丝均与 50 mL 稀盐酸反应,实验记录如下:
(1) 经查阅资料得知,镍与稀盐酸反应生成氯化镍(${NiCl_{2}}$)和氢气,则镍与稀盐酸反应的化学方程式是
Ni + 2HCl = NiCl₂ + H₂↑
。根据已学的知识分析得出,铜不能与稀盐酸发生化学反应的原因是在金属活动性顺序中,铜的活动性排在氢的后面
。(2) 小组同学分析得出,要判断三种金属的活动性强弱,必须在实验一的基础上增补一个实验才能得出结论,其实验内容为:另取一根粗细、长短相同的锌丝放入 50 mL 浓度为
15%
的稀盐酸中,观察放出气泡的快慢。小组最后得出锌的活动性最强的结论。(3) 实验时,有同学建议先用砂纸将三种金属丝表面进行打磨,目的是
除去氧化膜和杂质,便于反应
。【实验二】(4) 小组同学又设计了下表中的实验,成功地验证了三种金属的活动性强弱。
(4)
CuSO₄ 溶液(合理即可)
无明显现象
【拓展延伸】(5) 为了回收利用金属,同学们将实验一、实验二反应后的物质倒入同一容器中,向其中加入过量的铝粉,充分反应后过滤,则滤渣中的金属单质为
Al、Zn、Ni、Cu
(填化学式)。
答案:
(1)Ni + 2HCl = NiCl₂ + H₂↑ 在金属活动性顺序中,铜的活动性排在氢的后面
(2)15%
(3)除去氧化膜和杂质,便于反应
(4)CuSO₄ 溶液(合理即可) 无明显现象
(5)Al、Zn、Ni、Cu
(1)Ni + 2HCl = NiCl₂ + H₂↑ 在金属活动性顺序中,铜的活动性排在氢的后面
(2)15%
(3)除去氧化膜和杂质,便于反应
(4)CuSO₄ 溶液(合理即可) 无明显现象
(5)Al、Zn、Ni、Cu
9. 如下图,将金属 X 插入 ${AgNO_{3}}$ 溶液中,观察到溶液颜色变蓝后取出 X,再向烧杯内再加入一定量锌粉,振荡后,溶液蓝色逐渐消失。
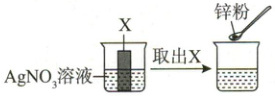
(1) 金属 X 是
(2) 加入锌粉,溶液蓝色消失的原因是
(3) 实验结束后,烧杯内的溶液中一定

(1) 金属 X 是
铜
。(2) 加入锌粉,溶液蓝色消失的原因是
Zn + Cu(NO₃)₂ = Cu + Zn(NO₃)₂
(用化学方程式表示)。(3) 实验结束后,烧杯内的溶液中一定
不存在
(填“存在”或“不存在”) ${AgNO_{3}}$。
答案:
(1)铜
(2)Zn + Cu(NO₃)₂ = Cu + Zn(NO₃)₂
(3)不存在
(1)铜
(2)Zn + Cu(NO₃)₂ = Cu + Zn(NO₃)₂
(3)不存在
10. 利用下图实验探究金属的化学性质。
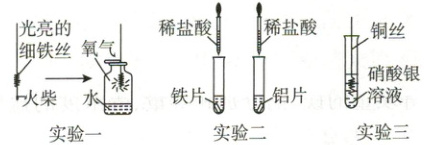
(1) 实验一:实验中观察到发出白光后,铁丝并未燃烧,原因是
(2) 实验二:两个反应均生成了
(3) 实验三:反应的化学方程式为


(1) 实验一:实验中观察到发出白光后,铁丝并未燃烧,原因是
火柴燃烧消耗了较多的氧气,使氧气不足
。(2) 实验二:两个反应均生成了
氢气
(填物质名称)。比较铁和铝的金属活动性强弱,从试剂角度需考虑:①加入同样大小的铁片和铝片;②加入等体积、等浓度的稀盐酸
。(3) 实验三:反应的化学方程式为
Cu + 2AgNO₃ = Cu(NO₃)₂ + 2Ag
。再补充一个实验可得出 Cu、Fe、Ag 的金属活动性顺序,请设计并进行实验,补全下表。
将铜丝插入硫酸亚铁溶液中(合理即可) 无明显变化(与上一空对应,合理即可)
答案:
(1)火柴燃烧消耗了较多的氧气,使氧气不足
(2)氢气 加入等体积、等浓度的稀盐酸
(3)Cu + 2AgNO₃ = Cu(NO₃)₂ + 2Ag
将铜丝插入硫酸亚铁溶液中(合理即可) 无明显变化(与上一空对应,合理即可)
(1)火柴燃烧消耗了较多的氧气,使氧气不足
(2)氢气 加入等体积、等浓度的稀盐酸
(3)Cu + 2AgNO₃ = Cu(NO₃)₂ + 2Ag
将铜丝插入硫酸亚铁溶液中(合理即可) 无明显变化(与上一空对应,合理即可)
查看更多完整答案,请扫码查看


