2025年效率暑假江苏人民出版社九年级化学沪教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年效率暑假江苏人民出版社九年级化学沪教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第7页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
20. 下列观点正确的是 ( )
A.元素周期律的发现,奠定了近代化学的基础
B.改变物质的性质一定要通过化学变化
C.在化学变化中原子的电子数不会发生变化
D.通过化学变化一定能改变物质的性质
A.元素周期律的发现,奠定了近代化学的基础
B.改变物质的性质一定要通过化学变化
C.在化学变化中原子的电子数不会发生变化
D.通过化学变化一定能改变物质的性质
答案:
D 解析:道尔顿的原子论和阿伏加德罗的分子学说,奠定了近代化学的基础,元素周期律的发现和元素周期表的编制,使化学在元素周期律的指导下,利用元素之间的一些规律性知识来分类学习物质的性质,使化学学习和研究变得有规律可循,A项错误;改变物质的物理性质不需要通过化学变化,B项错误;有些化学变化中原子会发生得失电子,因此反应前后原子的电子数会发生变化,C项错误;化学反应改变物质的化学性质和物理性质,D项正确。
21. 下列指定反应的化学方程式正确的是( )
A.铁丝在氧气中燃烧:$4Fe+3O_2\stackrel{点燃}{=}2Fe_2O_3$
B.铜和硝酸银反应:$Cu+AgNO_3= CuNO_3+Ag$
C.铜绿和稀盐酸反应:$Cu_2(OH)_2CO_3+4HCl= 2CuCl_2+3H_2O+CO_2\uparrow$
D.过氧化钠与二氧化碳反应生成纯碱和氧气:$2Na_2O_2+CO_2= 2Na_2CO_3+O_2\uparrow$
A.铁丝在氧气中燃烧:$4Fe+3O_2\stackrel{点燃}{=}2Fe_2O_3$
B.铜和硝酸银反应:$Cu+AgNO_3= CuNO_3+Ag$
C.铜绿和稀盐酸反应:$Cu_2(OH)_2CO_3+4HCl= 2CuCl_2+3H_2O+CO_2\uparrow$
D.过氧化钠与二氧化碳反应生成纯碱和氧气:$2Na_2O_2+CO_2= 2Na_2CO_3+O_2\uparrow$
答案:
C 解析:铁在氧气中燃烧生成四氧化三铁,A项错误;硝酸铜的化学式为${Cu(NO3)2}$,B项错误;铜绿和稀盐酸反应:${Cu2(OH)2CO3 + 4HCl = 2CuCl2 + 3H2O + CO2↑}$,C项正确;过氧化钠与二氧化碳反应生成纯碱和氧气:${2Na2O2 + 2CO2 = 2Na2CO3 + O2↑}$,D项错误。
22. 类推是化学学习中常用的思维方法。下列类推不正确的是 ( )
A.离子是带电的粒子,但是带电的粒子不一定是离子
B.氧化物中一定含有氧元素,但含有氧元素的化合物不一定是氧化物
C.单质是由同种元素组成的纯净物,所以同种元素组成的纯净物一定是单质
D.同种元素的粒子其质子数相同,所以质子数相同的粒子一定属于同种元素

A.离子是带电的粒子,但是带电的粒子不一定是离子
B.氧化物中一定含有氧元素,但含有氧元素的化合物不一定是氧化物
C.单质是由同种元素组成的纯净物,所以同种元素组成的纯净物一定是单质
D.同种元素的粒子其质子数相同,所以质子数相同的粒子一定属于同种元素
答案:
D 解析:带电的粒子也可以是电子,A项正确;氧化物是由两种元素组成的化合物,其中一种是氧,如果由两种以上元素组成的化合物,虽然含有氧元素也不是氧化物,B项正确;同种元素组成的物质可能是纯净物,也可能是混合物,但同种元素组成的纯净物一定是单质,C项正确;质子数相同的粒子如果是单核微粒属于同种元素,如果是多种原子构成的微粒就不成立,D项错误。
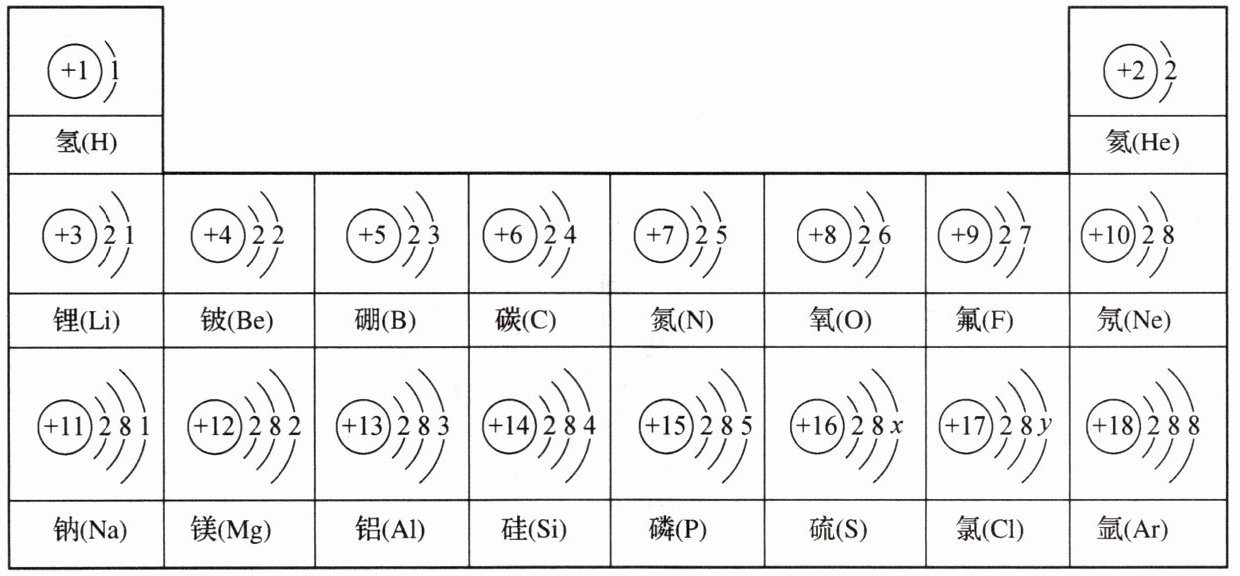
23. 下图是五种粒子的结构示意图,请回答下列问题:
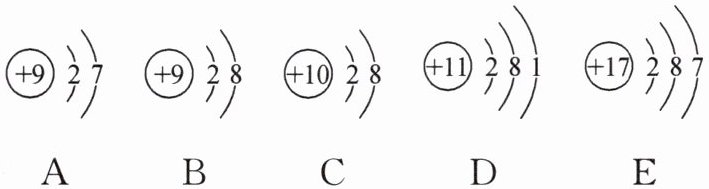
A (+9) 2 7 B (+9) 2 8 C (+10) 2 8 D (+11) 2 8 1 E (+17) 2 8 7
(1)具有相同的电子层结构的是 ;
(2)属于金属元素的是 ;
(3)属于稀有气体元素的是 ;
(4)属于阴离子的是 ,其离子符号是 ;
(5)原子化学性质相似的是 ;
(6)属于相对稳定结构的是 。
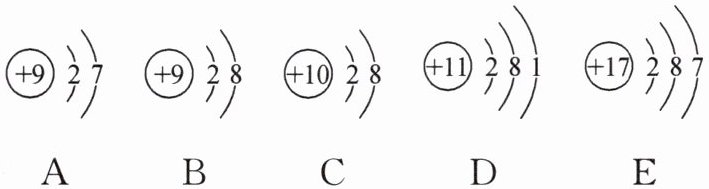
A (+9) 2 7 B (+9) 2 8 C (+10) 2 8 D (+11) 2 8 1 E (+17) 2 8 7
(1)具有相同的电子层结构的是 ;
(2)属于金属元素的是 ;
(3)属于稀有气体元素的是 ;
(4)属于阴离子的是 ,其离子符号是 ;
(5)原子化学性质相似的是 ;
(6)属于相对稳定结构的是 。
答案:
(1)BC
(2)D
(3)C
(4)B,${F-}$
(5)AE
(6)BC 解析:A是氟原子,B是氟离子${F-}$,C是氖原子,D是钠原子,E是氯原子。B和C电子层结构完全相同,均为稳定结构;D是金属元素;氖是稀有气体元素;最外层电子数相同的原子化学性质相似,A和E化学性质相似。
(1)BC
(2)D
(3)C
(4)B,${F-}$
(5)AE
(6)BC 解析:A是氟原子,B是氟离子${F-}$,C是氖原子,D是钠原子,E是氯原子。B和C电子层结构完全相同,均为稳定结构;D是金属元素;氖是稀有气体元素;最外层电子数相同的原子化学性质相似,A和E化学性质相似。
24. (1)用化学符号表示:两个氢分子 ,五个硫酸根离子 。
(2)用符号表示氢氧化铁中铁元素的化合价 。
(3)下列微粒结构示意图中共表示 种元素,属于离子的是 (填字母)。
A (+3) 2 1 B (+9) 2 7 C (+16) 2 8 6 D (+16) 2 8 8
(4)地壳中含量最多的元素与最多的金属元素形成的化合物的化学式 。
(2)用符号表示氢氧化铁中铁元素的化合价 。
(3)下列微粒结构示意图中共表示 种元素,属于离子的是 (填字母)。

A (+3) 2 1 B (+9) 2 7 C (+16) 2 8 6 D (+16) 2 8 8
(4)地壳中含量最多的元素与最多的金属元素形成的化合物的化学式 。
答案:
(1)${2H2}$ $5{SO^{2-}_{4}}$
(2)${\overset{+3}{Fe}(OH)3}$
(3)3 D
(4)${Al2O3}$ 解析:
(1)表示化学式中原子或原子团个数的数字写在元素符号或原子团符号的右下角,1个氢分子含有2个氢原子,因此1个氢分子表示为${H2}$;表示粒子个数的数字写在化学符号的前面,因此2个氢分子表示为${2H2}$;离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。但硫酸根离子是由多个原子组成的离子,整体带2个单位的负电荷,若表示多个该离子,就在其元素符号前加上相应的数字,所以答案为$5{SO^{2-}_{4}}$。
(2)元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后。
(3)根据当核电荷数=质子数=核外电子数,为原子;根据当核电荷数=质子数>核外电子数,为阳离子;当核电荷数=质子数<核外电子数,为阴离子;根据不同种元素最本质的区别是质子数不同,元素的种类由质子数决定,所以微粒结构示意图中共表示3种元素;由此可知微粒结构示意图中属于离子的是D。
(4)根据地壳里各元素的含量由多到少的顺序排列依次是氧、硅、铝、铁,因此地壳中含量最多的金属元素是Al,地壳中含量最多的元素是O,铝元素显$+3$价,氧元素显$-2$价,根据化合价原则,其组成的化合物是${Al2O3}$。
(1)${2H2}$ $5{SO^{2-}_{4}}$
(2)${\overset{+3}{Fe}(OH)3}$
(3)3 D
(4)${Al2O3}$ 解析:
(1)表示化学式中原子或原子团个数的数字写在元素符号或原子团符号的右下角,1个氢分子含有2个氢原子,因此1个氢分子表示为${H2}$;表示粒子个数的数字写在化学符号的前面,因此2个氢分子表示为${2H2}$;离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。但硫酸根离子是由多个原子组成的离子,整体带2个单位的负电荷,若表示多个该离子,就在其元素符号前加上相应的数字,所以答案为$5{SO^{2-}_{4}}$。
(2)元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后。
(3)根据当核电荷数=质子数=核外电子数,为原子;根据当核电荷数=质子数>核外电子数,为阳离子;当核电荷数=质子数<核外电子数,为阴离子;根据不同种元素最本质的区别是质子数不同,元素的种类由质子数决定,所以微粒结构示意图中共表示3种元素;由此可知微粒结构示意图中属于离子的是D。
(4)根据地壳里各元素的含量由多到少的顺序排列依次是氧、硅、铝、铁,因此地壳中含量最多的金属元素是Al,地壳中含量最多的元素是O,铝元素显$+3$价,氧元素显$-2$价,根据化合价原则,其组成的化合物是${Al2O3}$。
25. 下图为部分原子的结构示意图。小明同学对它进行研究:
(1)核电荷数为18的原子名称是 ,在化学反应中,该原子的化学性质 (填“活泼”或“不活泼”);氟原子的最外层电子数为 ,与氟原子化学性质相似的是 。
(2)核电荷数为8的原子得到两个电子后,形成的离子符号是 。
(3)小李同学发现上图的排列具有一定的规律,如:同一列原子的最外层电子数目相同。请你帮助他再找出两条规律:
① ;
② 。
(1)核电荷数为18的原子名称是 ,在化学反应中,该原子的化学性质 (填“活泼”或“不活泼”);氟原子的最外层电子数为 ,与氟原子化学性质相似的是 。
(2)核电荷数为8的原子得到两个电子后,形成的离子符号是 。
(3)小李同学发现上图的排列具有一定的规律,如:同一列原子的最外层电子数目相同。请你帮助他再找出两条规律:
① ;
② 。
答案:
(1)氩 不活泼 7 氯
(2)${O^{2-}}$
(3)同一行原子的电子层数相等 每一行最外层电子数从1逐渐增加到8(第一行由1到2) 解析:
(1)18号元素是氩,其原子为氩原子;氩原子最外层电子为8个,达到了稳定结构,因此不活泼;氟原子最外层有7个电子,在化学反应中易得电子形成8电子稳定结构,是活泼的非金属,与其性质相似的是同一列的氯原子。
(2)核电荷数为8的是氧元素,氧原子最外层是6个电子,得到2个电子形成稳定结构,因此形成的离子为${O^{2-}}$。
(3)同一行原子的电子层数相等;每一行最外层电子数从1逐渐增加到8(第一行由1到2)。
(1)氩 不活泼 7 氯
(2)${O^{2-}}$
(3)同一行原子的电子层数相等 每一行最外层电子数从1逐渐增加到8(第一行由1到2) 解析:
(1)18号元素是氩,其原子为氩原子;氩原子最外层电子为8个,达到了稳定结构,因此不活泼;氟原子最外层有7个电子,在化学反应中易得电子形成8电子稳定结构,是活泼的非金属,与其性质相似的是同一列的氯原子。
(2)核电荷数为8的是氧元素,氧原子最外层是6个电子,得到2个电子形成稳定结构,因此形成的离子为${O^{2-}}$。
(3)同一行原子的电子层数相等;每一行最外层电子数从1逐渐增加到8(第一行由1到2)。
查看更多完整答案,请扫码查看


