2025年效率暑假江苏人民出版社九年级化学沪教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年效率暑假江苏人民出版社九年级化学沪教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第26页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
27. 皮革厂的废水中含有一定量的氨氮(以$NH_3、$$NH_4⁺$形式存在),通过沉淀和氧化两步处理后可使水中氨氮达到国家规定的排放标准。
(1)沉淀:向酸性废水中加入适量$Fe_2(SO_4)_3$溶液,废水中的氨氮转化为$NH_4Fe_3(SO_4)_2(OH)_6$沉淀。
①该反应的离子方程式为______。
②废水中氨氮去除率随pH的变化如图1所示,当1.3<pH<1.8时,氨氮去除率随pH升高而降低的原因是______。

(2)氧化:调节经沉淀处理后的废水pH约为6,加入NaClO溶液进一步氧化处理。
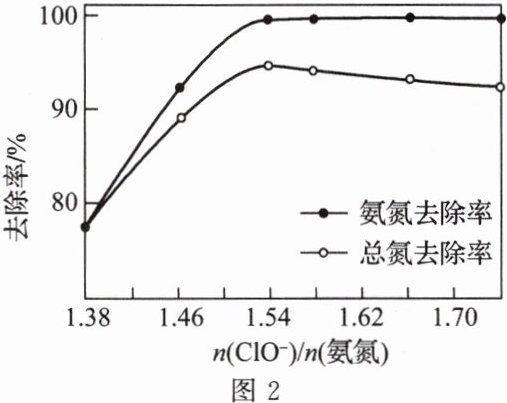
①NaClO将废水中的氨氮转化为$N_2,$该反应的离子方程式为______。
②研究发现,废水中氨氮去除率随温度升高呈先升后降趋势。当温度大于30℃时,废水中氨氮去除率随着温度升高而降低,其原因是______。
③n(ClO⁻)/n(氨氮)对废水中氨氮去除率和总氮去除率的影响如图2所示。当n(ClO⁻)/n(氨氮)>1.54后,总氮去除率下降的原因是______。
(1)沉淀:向酸性废水中加入适量$Fe_2(SO_4)_3$溶液,废水中的氨氮转化为$NH_4Fe_3(SO_4)_2(OH)_6$沉淀。
①该反应的离子方程式为______。
②废水中氨氮去除率随pH的变化如图1所示,当1.3<pH<1.8时,氨氮去除率随pH升高而降低的原因是______。

(2)氧化:调节经沉淀处理后的废水pH约为6,加入NaClO溶液进一步氧化处理。

①NaClO将废水中的氨氮转化为$N_2,$该反应的离子方程式为______。
②研究发现,废水中氨氮去除率随温度升高呈先升后降趋势。当温度大于30℃时,废水中氨氮去除率随着温度升高而降低,其原因是______。
③n(ClO⁻)/n(氨氮)对废水中氨氮去除率和总氮去除率的影响如图2所示。当n(ClO⁻)/n(氨氮)>1.54后,总氮去除率下降的原因是______。
答案:
(1)①NH₃ + 3Fe³⁺ + 2SO₄²⁻ + 6H₂O = NH₄Fe₃(SO₄)₂(OH)₆↓ + 5H⁺或NH₄⁺ + 3Fe³⁺ + 2SO₄²⁻ + 6H₂O = NH₄Fe₃(SO₄)₂(OH)₆↓ + 6H⁺;②pH有所增大,氢氧根离子浓度增大,不利于NH₄Fe₃(SO₄)₂(OH)₆沉淀生成,则氨氮去除率随pH升高而降低
(2)①3ClO⁻ + 2NH₄⁺ = N₂↑ + 3Cl⁻ + 3H₂O + 2H⁺或3HClO + 2NH₄⁺ = N₂↑ + 3Cl⁻ + 3H₂O + 5H⁺;②氧化剂次氯酸不稳定,温度升高受热分解;③次氯酸钠投放量过大,导致污水中部分氨氮氧化为其他价态例如硝酸根离子,则总氮去除率下降解析:
(1)图1中,pH由1.0逐渐升高到1.8،氨氮去除率先升高再降低,pH约为1.3时,氨氮去率达到最大值,但仍小于60%,然后随pH升高变小,但pH = 1.8时,氨氮去除率仍大于40%。①向酸性废水中,氨气或铵离子、铁离子、硫酸根离子和水反应,生成NH₄Fe₃(SO₄)₂(OH)₆沉淀,该反应的离子方程式为NH₃ + 3Fe³⁺ + 2SO₄²⁻ + 6H₂O = NH₄Fe₃(SO₄)₂(OH)₆↓ + 5H⁺或NH₄⁺ + 3Fe³⁺ + 2SO₄²⁻ + 6H₂O = NH₄Fe₃(SO₄)₂(OH)₆↓ + 6H⁺。②当1.3<pH<1.8时,随着氢离子浓度有所下降,氢氧根离子浓度增大,对NH₄Fe₃(SO₄)₂(OH)₆沉淀溶解平衡的影响是:不利于沉淀生成,则氨氮去除率随pH升高而降低。
(2)坐标图中,开始时随n(ClO⁻)/n(氨氮)增大氨氮去除率增大,但当n(ClO⁻)/n(氨氮)大于1.54时,氨氮去除率没有减小,但总氮去除率变小,是由于氧化剂ClO⁻的增加,导致将还原剂的氨氮氧化产生不是氮气,而是其他含氮化合物留在了溶液中。①NaClO具有氧化性,废水中的氨氮呈 - 3价,被氧化转化为N₂,还原产物为氯化钠,则该反应的离子方程式为3ClO⁻ + 2NH₄⁺ = N₂↑ + 3Cl⁻ + 3H₂O + 2H⁺或3HClO + 2NH₄⁺ = N₂↑ + 3Cl⁻ + 3H₂O + 5H⁺;②当温度大于30℃时,废水中氨氮去除率随着温度升高而降低,其原因是氧化剂次氯酸不稳定,温度升高受热分解。③当n(ClO⁻)/n(氨氮)>1.54后,次氯酸钠投放量过大,导致污水中部分氨氮氧化为其他价态例如硝酸根离子,则总氮去除率下降。
(1)①NH₃ + 3Fe³⁺ + 2SO₄²⁻ + 6H₂O = NH₄Fe₃(SO₄)₂(OH)₆↓ + 5H⁺或NH₄⁺ + 3Fe³⁺ + 2SO₄²⁻ + 6H₂O = NH₄Fe₃(SO₄)₂(OH)₆↓ + 6H⁺;②pH有所增大,氢氧根离子浓度增大,不利于NH₄Fe₃(SO₄)₂(OH)₆沉淀生成,则氨氮去除率随pH升高而降低
(2)①3ClO⁻ + 2NH₄⁺ = N₂↑ + 3Cl⁻ + 3H₂O + 2H⁺或3HClO + 2NH₄⁺ = N₂↑ + 3Cl⁻ + 3H₂O + 5H⁺;②氧化剂次氯酸不稳定,温度升高受热分解;③次氯酸钠投放量过大,导致污水中部分氨氮氧化为其他价态例如硝酸根离子,则总氮去除率下降解析:
(1)图1中,pH由1.0逐渐升高到1.8،氨氮去除率先升高再降低,pH约为1.3时,氨氮去率达到最大值,但仍小于60%,然后随pH升高变小,但pH = 1.8时,氨氮去除率仍大于40%。①向酸性废水中,氨气或铵离子、铁离子、硫酸根离子和水反应,生成NH₄Fe₃(SO₄)₂(OH)₆沉淀,该反应的离子方程式为NH₃ + 3Fe³⁺ + 2SO₄²⁻ + 6H₂O = NH₄Fe₃(SO₄)₂(OH)₆↓ + 5H⁺或NH₄⁺ + 3Fe³⁺ + 2SO₄²⁻ + 6H₂O = NH₄Fe₃(SO₄)₂(OH)₆↓ + 6H⁺。②当1.3<pH<1.8时,随着氢离子浓度有所下降,氢氧根离子浓度增大,对NH₄Fe₃(SO₄)₂(OH)₆沉淀溶解平衡的影响是:不利于沉淀生成,则氨氮去除率随pH升高而降低。
(2)坐标图中,开始时随n(ClO⁻)/n(氨氮)增大氨氮去除率增大,但当n(ClO⁻)/n(氨氮)大于1.54时,氨氮去除率没有减小,但总氮去除率变小,是由于氧化剂ClO⁻的增加,导致将还原剂的氨氮氧化产生不是氮气,而是其他含氮化合物留在了溶液中。①NaClO具有氧化性,废水中的氨氮呈 - 3价,被氧化转化为N₂,还原产物为氯化钠,则该反应的离子方程式为3ClO⁻ + 2NH₄⁺ = N₂↑ + 3Cl⁻ + 3H₂O + 2H⁺或3HClO + 2NH₄⁺ = N₂↑ + 3Cl⁻ + 3H₂O + 5H⁺;②当温度大于30℃时,废水中氨氮去除率随着温度升高而降低,其原因是氧化剂次氯酸不稳定,温度升高受热分解。③当n(ClO⁻)/n(氨氮)>1.54后,次氯酸钠投放量过大,导致污水中部分氨氮氧化为其他价态例如硝酸根离子,则总氮去除率下降。
28. 化学与生活、生产息息相关,根据所学知识回答下列问题:
(1)随意丢弃塑料会造成“白色污染”,塑料不属于______(填字母)。
A. 有机物
B. 合成材料
C. 纯净物
(2)能使硬水软化的方法是______(填字母)。
A. 加入明矾
B. 加入活性炭
C. 煮沸
(3)铁制品表面涂一层油漆能防锈蚀,其原理是阻止了铁与______接触。
(4)碳酸氢钠是治疗胃酸过多症的一种药剂,它与盐酸反应的化学方程式为______。
(5)医用生理盐水中含有一定量的氯离子,请画出Cl⁻的离子结构示意图:______。
(1)随意丢弃塑料会造成“白色污染”,塑料不属于______(填字母)。
A. 有机物
B. 合成材料
C. 纯净物
(2)能使硬水软化的方法是______(填字母)。
A. 加入明矾
B. 加入活性炭
C. 煮沸
(3)铁制品表面涂一层油漆能防锈蚀,其原理是阻止了铁与______接触。
(4)碳酸氢钠是治疗胃酸过多症的一种药剂,它与盐酸反应的化学方程式为______。
(5)医用生理盐水中含有一定量的氯离子,请画出Cl⁻的离子结构示意图:______。
答案:
(1)C
(2)C
(3)空气和水(或氧气和水)
(4)NaHCO₃ + HCl = NaCl + CO₂↑ + H₂O
(5)
(1)C
(2)C
(3)空气和水(或氧气和水)
(4)NaHCO₃ + HCl = NaCl + CO₂↑ + H₂O
(5)

查看更多完整答案,请扫码查看


