第70页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
9 两份质量相等的碳,一份与足量氧气完全反应生成二氧化碳,另一份与氧气反应全部生成一氧化碳,则前者与后者消耗氧气的质量比为(
A.3∶4
B.3∶8
C.2∶1
D.1∶2
C
)A.3∶4
B.3∶8
C.2∶1
D.1∶2
答案:
C
10 一定质量的碳和氧化铜混合物,高温下反应至固体质量不再减小,固体总质量的变化如图。下列说法正确的是 (
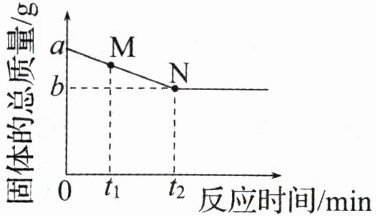
A.M点对应的固体物质只有两种
B.N点对应的固体是铜
C.固体质量减少,该反应不遵守质量守恒定律
$D.0~t_2 min,$固体中碳元素的质量减小
D
)
A.M点对应的固体物质只有两种
B.N点对应的固体是铜
C.固体质量减少,该反应不遵守质量守恒定律
$D.0~t_2 min,$固体中碳元素的质量减小
答案:
D
11 碳还原氧化铜的实验如图所示,实验结束时停止加热。冷却至室温。相关分析正确的是 (
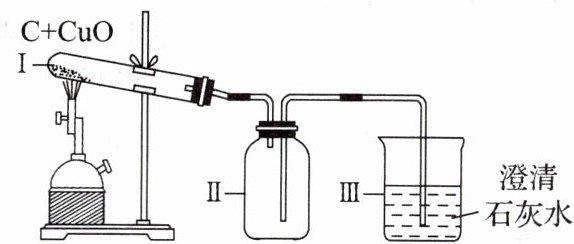
A.装置Ⅲ中出现气泡,说明Ⅰ中反应已开始
B.反应中,装置Ⅰ内壁出现水雾是反应生成的
C.试管中CuO发生了还原反应
D.装置Ⅱ中可收集到一瓶二氧化碳气体
C
)
A.装置Ⅲ中出现气泡,说明Ⅰ中反应已开始
B.反应中,装置Ⅰ内壁出现水雾是反应生成的
C.试管中CuO发生了还原反应
D.装置Ⅱ中可收集到一瓶二氧化碳气体
答案:
C
(1)物质X的化学式为
(2)焦炭常用于冶金工业,这是利用了焦炭的
(3)写出如图转化关系中属于分解反应的一个化学方程式:
$\mathrm{C}{\mathrm{O}}_{2}$
,写出其一种用途:二氧化碳可以灭火
。(2)焦炭常用于冶金工业,这是利用了焦炭的
还原性
,写出一个利用此性质的化学方程式:$2\mathrm{F}{\mathrm{e}}_{2}{\mathrm{O}}_{3}+3\mathrm{C}\xlongequal{高温}4\mathrm{F}\mathrm{e}+3\mathrm{C}{\mathrm{O}}_{2}\uparrow$
。(3)写出如图转化关系中属于分解反应的一个化学方程式:
$\mathrm{C}\mathrm{a}\mathrm{C}{\mathrm{O}}_{3}\xlongequal{高温}\mathrm{C}\mathrm{a}\mathrm{O}+\mathrm{C}{\mathrm{O}}_{2}\uparrow$(或${\mathrm{H}}_{2}\mathrm{C}{\mathrm{O}}_{3}\xlongequal{\;\;}{\mathrm{H}}_{2}\mathrm{O}+\mathrm{C}{\mathrm{O}}_{2}\uparrow$)
。
答案:
(1)$\mathrm{C}{\mathrm{O}}_{2}$ 二氧化碳可以灭火
(2)还原性 $2\mathrm{F}{\mathrm{e}}_{2}{\mathrm{O}}_{3}+3\mathrm{C}\xlongequal{高温}4\mathrm{F}\mathrm{e}+3\mathrm{C}{\mathrm{O}}_{2}\uparrow$
(3)$\mathrm{C}\mathrm{a}\mathrm{C}{\mathrm{O}}_{3}\xlongequal{高温}\mathrm{C}\mathrm{a}\mathrm{O}+\mathrm{C}{\mathrm{O}}_{2}\uparrow$(或${\mathrm{H}}_{2}\mathrm{C}{\mathrm{O}}_{3}\xlongequal{\;\;}{\mathrm{H}}_{2}\mathrm{O}+\mathrm{C}{\mathrm{O}}_{2}\uparrow$)
(1)$\mathrm{C}{\mathrm{O}}_{2}$ 二氧化碳可以灭火
(2)还原性 $2\mathrm{F}{\mathrm{e}}_{2}{\mathrm{O}}_{3}+3\mathrm{C}\xlongequal{高温}4\mathrm{F}\mathrm{e}+3\mathrm{C}{\mathrm{O}}_{2}\uparrow$
(3)$\mathrm{C}\mathrm{a}\mathrm{C}{\mathrm{O}}_{3}\xlongequal{高温}\mathrm{C}\mathrm{a}\mathrm{O}+\mathrm{C}{\mathrm{O}}_{2}\uparrow$(或${\mathrm{H}}_{2}\mathrm{C}{\mathrm{O}}_{3}\xlongequal{\;\;}{\mathrm{H}}_{2}\mathrm{O}+\mathrm{C}{\mathrm{O}}_{2}\uparrow$)
13 用如图所示的玻璃管进行碳还原氧化铜实验。
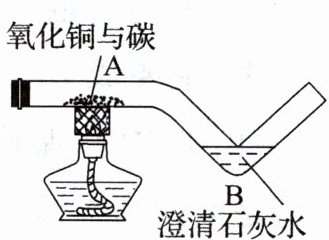
(1)B处的实验现象是澄清石灰水变浑浊,A处的现象是
(2)查阅资料发现:反应生成的红色固体除了铜以外还可能有氧化亚铜($Cu_2O$),则生成氧化亚铜的化学方程式为

(1)B处的实验现象是澄清石灰水变浑浊,A处的现象是
黑色粉末变成红色物质
。(2)查阅资料发现:反应生成的红色固体除了铜以外还可能有氧化亚铜($Cu_2O$),则生成氧化亚铜的化学方程式为
$\mathrm{C}+4\mathrm{C}\mathrm{u}\mathrm{O}\xlongequal{高温}2\mathrm{C}{\mathrm{u}}_{2}\mathrm{O}+\mathrm{C}{\mathrm{O}}_{2}\uparrow$
。
答案:
【解析】
(1)由于碳具有还原性,当观察到B处的现象是澄清石灰水变浑浊时,说明碳还原氧化铜生成铜和二氧化碳,则A处的现象是黑色粉末变成红色物质。
(2)由题意可知,在加热时,碳与氧化铜反应生成氧化亚铜的化学方程式为$\mathrm{C}+4\mathrm{C}\mathrm{u}\mathrm{O}\xlongequal{高温}2\mathrm{C}{\mathrm{u}}_{2}\mathrm{O}+\mathrm{C}{\mathrm{O}}_{2}\uparrow$。答案:
(1)黑色粉末变成红色物质
(2)$\mathrm{C}+4\mathrm{C}\mathrm{u}\mathrm{O}\xlongequal{高温}2\mathrm{C}{\mathrm{u}}_{2}\mathrm{O}+\mathrm{C}{\mathrm{O}}_{2}\uparrow$
(1)由于碳具有还原性,当观察到B处的现象是澄清石灰水变浑浊时,说明碳还原氧化铜生成铜和二氧化碳,则A处的现象是黑色粉末变成红色物质。
(2)由题意可知,在加热时,碳与氧化铜反应生成氧化亚铜的化学方程式为$\mathrm{C}+4\mathrm{C}\mathrm{u}\mathrm{O}\xlongequal{高温}2\mathrm{C}{\mathrm{u}}_{2}\mathrm{O}+\mathrm{C}{\mathrm{O}}_{2}\uparrow$。答案:
(1)黑色粉末变成红色物质
(2)$\mathrm{C}+4\mathrm{C}\mathrm{u}\mathrm{O}\xlongequal{高温}2\mathrm{C}{\mathrm{u}}_{2}\mathrm{O}+\mathrm{C}{\mathrm{O}}_{2}\uparrow$
14 数字化实验 将一定质量炭粉在密闭容器中引燃(如图1),一段时间后炭粉消失。用压强传感器测得容器内压强(同温下,容器内压强与气体分子数成正比)随时间的变化关系如图2。下列分析正确的是 (
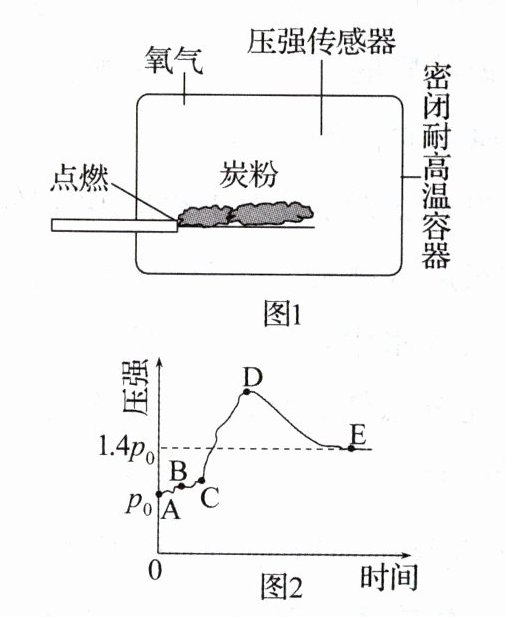
A.AB段炭粉开始燃烧
B.反应生成的$CO_2$导致CD段压强增大
C.E点气体的成分是$CO_2$和CO
D.燃烧放出的热量减少导致DE段压强下降
C
)
A.AB段炭粉开始燃烧
B.反应生成的$CO_2$导致CD段压强增大
C.E点气体的成分是$CO_2$和CO
D.燃烧放出的热量减少导致DE段压强下降
答案:
C
查看更多完整答案,请扫码查看


