第66页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
(1)反应①、②使用的催化剂在反应前后的
(2)反应①的能量转化形式中存在光能转化为
(3)反应②的化学方程式:${2CO2 + 6H2 \xlongequal{催化剂} 4H2O + X}$,则 X 的化学式为
(4)反应②生成的水全部循环利用,为使该过程持续发生,反应①需要不断补充水,其原因是
质量
和化学性质都没有发生变化。(2)反应①的能量转化形式中存在光能转化为
化学能
,产生的${H2}$、${O2}$的体积比约为2:1
。(3)反应②的化学方程式:${2CO2 + 6H2 \xlongequal{催化剂} 4H2O + X}$,则 X 的化学式为
${C2H4}$
;可用澄清石灰水
检验反应后的气体中是否还含有${CO2}$。(4)反应②生成的水全部循环利用,为使该过程持续发生,反应①需要不断补充水,其原因是
由化学方程式可知,反应①中消耗水的量大于反应②中生成水的量
。
答案:
(1)质量
(2)化学能 2:1
(3)${C2H4}$ 澄清石灰水
(4)由化学方程式可知,反应①中消耗水的量大于反应②中生成水的量
(1)质量
(2)化学能 2:1
(3)${C2H4}$ 澄清石灰水
(4)由化学方程式可知,反应①中消耗水的量大于反应②中生成水的量
8(2023·宜宾中考改编)将${MnO2}和{KClO3}$的固体混合物 35.0 g 加热至质量不再变化为止(反应的化学方程式为${2KClO3 \xlongequal[\Delta]{MnO2} 2KCl + 3O2↑}$),冷却后称得剩余固体质量为 25.4 g,回答下列问题:
(1)生成${O2}$的质量为______
(1)生成${O2}$的质量为______
9.6g
。(写出计算过程)
答案:
【解析】
(1)生成${O2}$的质量为$35\ g-25.4\ g=9.6\ g$;
(2)解:设参加反应的氯酸钾的质量为$x$。${2KClO3}\xlongequal[\triangle]{{MnO2}}{2KCl}+{3O2}\uparrow$$245$$96$$x$$9.6\ g$$\dfrac{245}{96}=\dfrac{x}{9.6\ g}$$x=24.5\ g$反应前固体混合物中${MnO2}$的质量为$35.0\ g-24.5\ g=10.5\ g$。答:反应前固体混合物中${MnO2}$的质量为$10.5\ g$。
(1)生成${O2}$的质量为$35\ g-25.4\ g=9.6\ g$;
(2)解:设参加反应的氯酸钾的质量为$x$。${2KClO3}\xlongequal[\triangle]{{MnO2}}{2KCl}+{3O2}\uparrow$$245$$96$$x$$9.6\ g$$\dfrac{245}{96}=\dfrac{x}{9.6\ g}$$x=24.5\ g$反应前固体混合物中${MnO2}$的质量为$35.0\ g-24.5\ g=10.5\ g$。答:反应前固体混合物中${MnO2}$的质量为$10.5\ g$。
9(2023·河南中考)如图为治理汽车尾气时发生反应的微观示意图。下列有关说法不正确的是 (
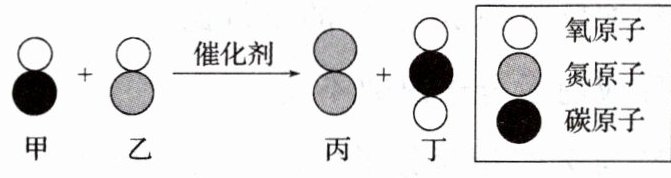
A.该反应能使有害气体转化为无害物质
B.反应前后原子的种类、数目不变
C.反应生成丙和丁的质量比为 7∶11
D.化学方程式为${2CO + 2NO \xlongequal{催化剂} N2 + 2CO2}$
C
)
A.该反应能使有害气体转化为无害物质
B.反应前后原子的种类、数目不变
C.反应生成丙和丁的质量比为 7∶11
D.化学方程式为${2CO + 2NO \xlongequal{催化剂} N2 + 2CO2}$
答案:
C 由物质的变化和性质可知,此反应把污染环境的有害气体${CO}$和${NO}$转化成了无害的${CO2}$和${N2}$,A正确。由质量守恒定律可知,反应前后原子的种类、数目不变,B正确。由微观反应示意图可知,在催化剂的催化作用下,一氧化氮和一氧化碳反应生成二氧化碳和氮气,化学方程式为${2CO + 2NO}\xlongequal{催化剂}{N2 + 2CO2}$,反应生成丙和丁的质量比为$28:(44×2)=7:22$,C错误,D正确。
10 产业应用 (2023·北京中考)氧化亚铜(${Cu2O}$)可用于电镀工业。干法生产${Cu2O}$粉末的主要工艺流程如下:

(1)粉碎机中,发生的变化属于
(2)800~900 ℃时,煅烧炉中发生化合反应,该反应的化学方程式为

(1)粉碎机中,发生的变化属于
物理变化
。(2)800~900 ℃时,煅烧炉中发生化合反应,该反应的化学方程式为
${CuO + Cu}\xlongequal{800~900\ \hspace{0pt}^{\circ}C}{Cu2O}$
。
答案:
(1)物理变化 (2)${CuO + Cu}\xlongequal{800~900\ \hspace{0pt}^{\circ}C}{Cu2O}$
(1)计算 1 L 水样中${NaNO2}$的质量。
(2)查阅《食品安全国家标准(GB2762-2022)》,经换算,合格饮用水中${NaNO2}的含量应低于7.50×10^{-3}\ mg·L^{-1}$。结合计算结果,得出的结论是喝反复烧开的饮用水
2.76×10^{-3} mg
(2)查阅《食品安全国家标准(GB2762-2022)》,经换算,合格饮用水中${NaNO2}的含量应低于7.50×10^{-3}\ mg·L^{-1}$。结合计算结果,得出的结论是喝反复烧开的饮用水
不会
(填“会”或“不会”)造成亚硝酸盐中毒。
答案:
【解析】
(1)解:设$1\ L$水样中${NaNO2}$的质量为$x$。${2NaNO2}+{2KI}+{2H2SO4}\xlongequal{}{2NO}\uparrow+{I2}+{2H2O}+{K2SO4}+{Na2SO4}$$138$$254$$x$$5.08×10^{-3}\ mg$$\dfrac{138}{254}=\dfrac{x}{5.08×10^{-3}\ mg}$$x=2.76×10^{-3}\ mg$答:$1\ L$水样中${NaNO2}$的质量为$2.76×10^{-3}\ mg$。
(2)不会
(1)解:设$1\ L$水样中${NaNO2}$的质量为$x$。${2NaNO2}+{2KI}+{2H2SO4}\xlongequal{}{2NO}\uparrow+{I2}+{2H2O}+{K2SO4}+{Na2SO4}$$138$$254$$x$$5.08×10^{-3}\ mg$$\dfrac{138}{254}=\dfrac{x}{5.08×10^{-3}\ mg}$$x=2.76×10^{-3}\ mg$答:$1\ L$水样中${NaNO2}$的质量为$2.76×10^{-3}\ mg$。
(2)不会
查看更多完整答案,请扫码查看


