第60页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
8 31 g红磷与50 g氧气充分反应,生成五氧化二磷的质量是(
A.一定等于81 g
B.一定小于81 g
C.一定大于81 g
D.不能确定
B
)A.一定等于81 g
B.一定小于81 g
C.一定大于81 g
D.不能确定
答案:
B 根据红磷燃烧的化学方程式可知,与31 g红磷完全反应的氧气的质量为40 g,则生成五氧化二磷的质量为31 g+40 g=71 g,小于81 g。
9 (2023·绥化中考)在化学反应A+2B= C+2D中,已知C和D的相对分子质量之比是22∶9,当6.4 g B与足量A完全反应后,生成3.6 g D。则在此反应中,B和C的质量比是(
A.8∶11
B.2∶11
C.16∶11
D.16∶9
C
)A.8∶11
B.2∶11
C.16∶11
D.16∶9
答案:
C 设生成C的质量为x。
A+2B= C + 2D
22 2×9
x 3.6 g
22/(2×9)=x/3.6 g x=4.4 g,则生成C的质量为4.4 g,所以在此反应中B和C的质量比是6.4 g:4.4 g=16:11。
A+2B= C + 2D
22 2×9
x 3.6 g
22/(2×9)=x/3.6 g x=4.4 g,则生成C的质量为4.4 g,所以在此反应中B和C的质量比是6.4 g:4.4 g=16:11。
10 (2023·深圳中考节选)某同学在$H_2O_2$溶液中加入$MnO_2$作催化剂时,反应生成气体的质量与时间的关系如图所示,求反应90s时消耗$H_2O_2$的质量。(写出计算过程)


答案:
【解析】由图可知,反应90 s时,生成氧气的质量为1.60 g,结合化学方程式计算出消耗过氧化氢的质量。
答案:解:设反应90 s时消耗过氧化氢的质量为x。
2H₂O₂MnO₂2H₂O+O₂↑
68 32
x 1.60 g
68/32=x/1.60 g x=3.4 g
答:反应90 s时消耗H₂O₂的质量为3.4 g。
答案:解:设反应90 s时消耗过氧化氢的质量为x。
2H₂O₂MnO₂2H₂O+O₂↑
68 32
x 1.60 g
68/32=x/1.60 g x=3.4 g
答:反应90 s时消耗H₂O₂的质量为3.4 g。
11 (2023·陕西中考A卷改编)学习小组同学利用如图实验,回收实验室废弃的铜粉与铁粉混合物中的铜粉(提示:$Fe+H_2SO_4= FeSO_4+H_2↑)。$

请完成下列分析及计算:
(1)反应生成氢气的质量是
(2)计算上述实验回收铜粉的质量。(忽略回收过程中铜粉的损失)

请完成下列分析及计算:
(1)反应生成氢气的质量是
0.4
g。(2)计算上述实验回收铜粉的质量。(忽略回收过程中铜粉的损失)
答案:
(1)0.4
(2)解:设混合物中铁粉的质量为x。
Fe+H₂SO₄=FeSO₄+H₂↑
56 2
x 0.4 g
56/2=x/0.4 g x=11.2 g
混合物中铜粉的质量为30 g-11.2 g=18.8 g
答:实验回收铜粉的质量为18.8 g。
(1)0.4
(2)解:设混合物中铁粉的质量为x。
Fe+H₂SO₄=FeSO₄+H₂↑
56 2
x 0.4 g
56/2=x/0.4 g x=11.2 g
混合物中铜粉的质量为30 g-11.2 g=18.8 g
答:实验回收铜粉的质量为18.8 g。
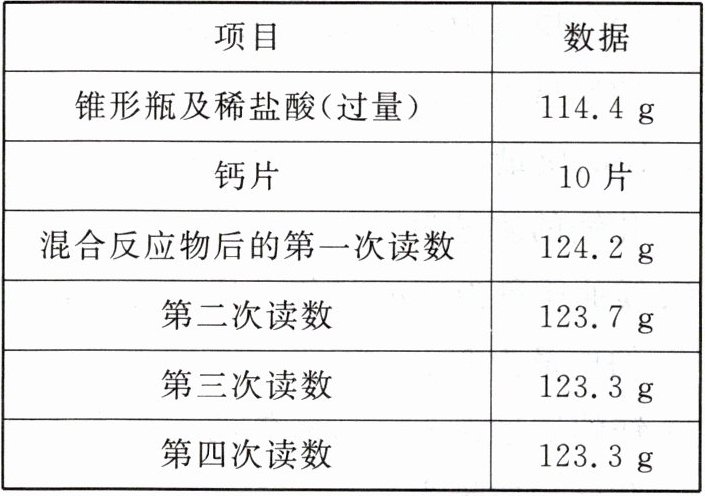
12 (2023·东营中考)小明奶奶患上骨质疏松症,医生建议每天需要补钙0.6~1克,药店现有标签所示的钙片(图1),若仅依靠服用规定量钙片,是否满足每天补钙的需求,小明对此问题展开探究,用电子天平(图2)测得相关数据见下表:

(1)通过计算说明按规定量服用能否满足每天补钙需求?
(2)


(1)通过计算说明按规定量服用能否满足每天补钙需求?
(2)
小明
小亮同学也取10片钙片与过量的稀盐酸反应,将生成的气体通过澄清石灰水,记录石灰水反应前后的质量,你认为用哪位同学的实验数据计算更准确______。
答案:
【解析】
(1)由图表可知,第三次与第四次反应后称量的质量相等,说明,第三次已是完全反应,根据质量守恒定律,在化学反应中,参加反应的各物质的质量总和等于反应后生成的各物质的质量总和,完全反应后生成二氧化碳的质量=反应前各物质的质量总和-反应后各物质的质量总和;由二氧化碳的质量根据碳酸钙与盐酸反应的化学方程式可以计算出碳酸钙的质量,进一步计算含钙量;
(2)小明同学的方案更可靠一些,因为在通入澄清石灰水的过程中导管和反应容器内的二氧化碳不能全部排出,小亮同学的方案不可靠。
答案:
(1)解:产生二氧化碳的质量=114.4 g+10片×100 g/100片-123.3 g=1.1 g;
设生成1.1 g二氧化碳需要碳酸钙的质量是x。
CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑
100 44
x 1.1 g
100/44=x/1.1 g,x=2.5 g
每天补钙的质量为2.5 g/10片×3片×40/100×100%=0.3 g,医生建议每天需要补钙0.6~1克,所以按规定量服用不能满足每天补钙需求。
(2)小明
(1)由图表可知,第三次与第四次反应后称量的质量相等,说明,第三次已是完全反应,根据质量守恒定律,在化学反应中,参加反应的各物质的质量总和等于反应后生成的各物质的质量总和,完全反应后生成二氧化碳的质量=反应前各物质的质量总和-反应后各物质的质量总和;由二氧化碳的质量根据碳酸钙与盐酸反应的化学方程式可以计算出碳酸钙的质量,进一步计算含钙量;
(2)小明同学的方案更可靠一些,因为在通入澄清石灰水的过程中导管和反应容器内的二氧化碳不能全部排出,小亮同学的方案不可靠。
答案:
(1)解:产生二氧化碳的质量=114.4 g+10片×100 g/100片-123.3 g=1.1 g;
设生成1.1 g二氧化碳需要碳酸钙的质量是x。
CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑
100 44
x 1.1 g
100/44=x/1.1 g,x=2.5 g
每天补钙的质量为2.5 g/10片×3片×40/100×100%=0.3 g,医生建议每天需要补钙0.6~1克,所以按规定量服用不能满足每天补钙需求。
(2)小明
查看更多完整答案,请扫码查看


