2025年快乐暑假八升九年级科学浙教版延边人民出版社
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年快乐暑假八升九年级科学浙教版延边人民出版社 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第58页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
21. 兴趣小组实验中,将NaOH溶液滴入$CuSO_{4}$溶液中,结果溶液中生成了浅绿色的固体。于是,他们对该浅绿色固体的成分进行探究。
【查阅资料】
①NaOH与$CuSO_{4}反应会生成Cu(OH)_{2}$,也会生成$Cu_{4}(OH)_{6}SO_{4}$(碱式硫酸铜);
②$Cu(OH)_{2}$在80℃会分解生成CuO;
③$Cu_{4}(OH)_{6}SO_{4}$不溶于水,能与酸反应,分解温度需300℃。
【猜想与假设】
猜想一:浅绿色固体为$Cu(OH)_{2}$;
猜想二:浅绿色固体为$Cu_{4}(OH)_{6}SO_{4}$;
猜想三:浅绿色固体为$Cu_{4}(OH)_{6}SO_{4}和Cu(OH)_{2}$。
【获取事实与证据】
(1)取少量浅绿色固体放入试管中,加热至100℃,观察到黑色固体物质,说明浅绿色固体中存在
(2)另取少量浅绿色固体放入试管中,加入足量稀硝酸,再滴加$Ba(NO_{3})_{2}$溶液,出现白色沉淀,该白色沉淀是
【结论】
(3)分析整个实验现象,你能得出的实验结论是
【应用】
(4)碱式硫酸铜在植物表面上能逐步释放铜离子,抑制真菌孢子萌发和菌丝发育,能有效防治作物的真菌及细菌性病害。农业上常用作
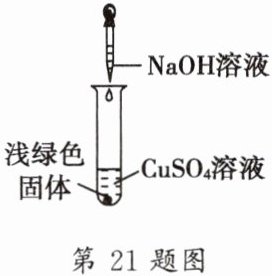
【查阅资料】
①NaOH与$CuSO_{4}反应会生成Cu(OH)_{2}$,也会生成$Cu_{4}(OH)_{6}SO_{4}$(碱式硫酸铜);
②$Cu(OH)_{2}$在80℃会分解生成CuO;
③$Cu_{4}(OH)_{6}SO_{4}$不溶于水,能与酸反应,分解温度需300℃。
【猜想与假设】
猜想一:浅绿色固体为$Cu(OH)_{2}$;
猜想二:浅绿色固体为$Cu_{4}(OH)_{6}SO_{4}$;
猜想三:浅绿色固体为$Cu_{4}(OH)_{6}SO_{4}和Cu(OH)_{2}$。
【获取事实与证据】
(1)取少量浅绿色固体放入试管中,加热至100℃,观察到黑色固体物质,说明浅绿色固体中存在
氢氧化铜
。(2)另取少量浅绿色固体放入试管中,加入足量稀硝酸,再滴加$Ba(NO_{3})_{2}$溶液,出现白色沉淀,该白色沉淀是
$BaSO_{4}$
。(填化学式)【结论】
(3)分析整个实验现象,你能得出的实验结论是
浅绿色固体为$Cu(OH)_{2}$和$Cu_{4}(OH)_{6}SO_{4}$
。【应用】
(4)碱式硫酸铜在植物表面上能逐步释放铜离子,抑制真菌孢子萌发和菌丝发育,能有效防治作物的真菌及细菌性病害。农业上常用作
灭菌剂或杀虫剂
。
答案:
(1)氢氧化铜
(2)$BaSO_{4}$
(3)浅绿色固体为$Cu(OH)_{2}$和$Cu_{4}(OH)_{6}SO_{4}$
(4)灭菌剂或杀虫剂
(1)氢氧化铜
(2)$BaSO_{4}$
(3)浅绿色固体为$Cu(OH)_{2}$和$Cu_{4}(OH)_{6}SO_{4}$
(4)灭菌剂或杀虫剂
22. 在一烧杯中盛有$CaCl_{2}$和HCl的混合溶液100g,向其中逐渐滴加溶质质量分数为10%的$Na_{2}CO_{3}$溶液,混合溶液的质量与所滴入的$Na_{2}CO_{3}$溶液的质量关系图像如图所示。
(1)在实验过程中,其中出现冒气泡现象的是
(2)逐渐滴入碳酸钠溶液的过程中,杯中溶液的pH如何变化?
(3)原溶液中HCl的质量是多少克?
(4)当滴入$Na_{2}CO_{3}$溶液至图中B点时,通过计算求烧杯中(不饱和溶液)溶质的质量分数。(计算结果精确到0.1%)
(1)在实验过程中,其中出现冒气泡现象的是
PA
(填“PA”或“AB”)段。(2)逐渐滴入碳酸钠溶液的过程中,杯中溶液的pH如何变化?
先增大后不变再增大
(3)原溶液中HCl的质量是多少克?
设 HCl 的质量为 x
$Na_{2}CO_{3}+2HCl=2NaCl+H_{2}O+CO_{2}\uparrow $
106 73
$106g×10\% $ x
$\frac {106}{106g×10\% }=\frac {73}{x}$
$x=7.3g$
$Na_{2}CO_{3}+2HCl=2NaCl+H_{2}O+CO_{2}\uparrow $
106 73
$106g×10\% $ x
$\frac {106}{106g×10\% }=\frac {73}{x}$
$x=7.3g$
(4)当滴入$Na_{2}CO_{3}$溶液至图中B点时,通过计算求烧杯中(不饱和溶液)溶质的质量分数。(计算结果精确到0.1%)
设与 HCl 反应产生 NaCl 的质量为 y,产生二氧化碳的质量为 z
$Na_{2}CO_{3}+2HCl=2NaCl+H_{2}O+CO_{2}\uparrow $
106 117 44
$106g×10\% $ y z
$\frac {106}{106g×10\% }=\frac {117}{y}=\frac {44}{z}$
$y=11.7g,z=4.4g$
设与$CaCl_{2}$反应产生的$CaCO_{3}$的质量为 m,产生 NaCl 的质量为 n
$Na_{2}CO_{3}+CaCl_{2}=CaCO_{3}\downarrow +2NaCl$
106 100 117
$(212-106)g×10\% $ m n
$\frac {106}{(212-106)g×10\% }=\frac {100}{m}=\frac {117}{n}$
$m=10g,n=11.7g$
$m_{溶液}=100g+212g-4.4g-10g=297.6g$
$NaCl\% =\frac {11.7g+11.7g}{297.6g}×100\% =7.9\% $
$Na_{2}CO_{3}+2HCl=2NaCl+H_{2}O+CO_{2}\uparrow $
106 117 44
$106g×10\% $ y z
$\frac {106}{106g×10\% }=\frac {117}{y}=\frac {44}{z}$
$y=11.7g,z=4.4g$
设与$CaCl_{2}$反应产生的$CaCO_{3}$的质量为 m,产生 NaCl 的质量为 n
$Na_{2}CO_{3}+CaCl_{2}=CaCO_{3}\downarrow +2NaCl$
106 100 117
$(212-106)g×10\% $ m n
$\frac {106}{(212-106)g×10\% }=\frac {100}{m}=\frac {117}{n}$
$m=10g,n=11.7g$
$m_{溶液}=100g+212g-4.4g-10g=297.6g$
$NaCl\% =\frac {11.7g+11.7g}{297.6g}×100\% =7.9\% $
答案:
(1)PA
(2)先增大后不变再增大
(3)设 HCl 的质量为 x
$Na_{2}CO_{3}+2HCl=2NaCl+H_{2}O+CO_{2}\uparrow $
106 73
$106g×10\% $ x
$\frac {106}{106g×10\% }=\frac {73}{x}$
$x=7.3g$
(4)设与 HCl 反应产生 NaCl 的质量为 y,产生二氧化碳的质量为 z
$Na_{2}CO_{3}+2HCl=2NaCl+H_{2}O+CO_{2}\uparrow $
106 117 44
$106g×10\% $ y z
$\frac {106}{106g×10\% }=\frac {117}{y}=\frac {44}{z}$
$y=11.7g,z=4.4g$
设与$CaCl_{2}$反应产生的$CaCO_{3}$的质量为 m,产生 NaCl 的质量为 n
$Na_{2}CO_{3}+CaCl_{2}=CaCO_{3}\downarrow +2NaCl$
106 100 117
$(212-106)g×10\% $ m n
$\frac {106}{(212-106)g×10\% }=\frac {100}{m}=\frac {117}{n}$
$m=10g,n=11.7g$
$m_{溶液}=100g+212g-4.4g-10g=297.6g$
$NaCl\% =\frac {11.7g+11.7g}{297.6g}×100\% =7.9\% $
(1)PA
(2)先增大后不变再增大
(3)设 HCl 的质量为 x
$Na_{2}CO_{3}+2HCl=2NaCl+H_{2}O+CO_{2}\uparrow $
106 73
$106g×10\% $ x
$\frac {106}{106g×10\% }=\frac {73}{x}$
$x=7.3g$
(4)设与 HCl 反应产生 NaCl 的质量为 y,产生二氧化碳的质量为 z
$Na_{2}CO_{3}+2HCl=2NaCl+H_{2}O+CO_{2}\uparrow $
106 117 44
$106g×10\% $ y z
$\frac {106}{106g×10\% }=\frac {117}{y}=\frac {44}{z}$
$y=11.7g,z=4.4g$
设与$CaCl_{2}$反应产生的$CaCO_{3}$的质量为 m,产生 NaCl 的质量为 n
$Na_{2}CO_{3}+CaCl_{2}=CaCO_{3}\downarrow +2NaCl$
106 100 117
$(212-106)g×10\% $ m n
$\frac {106}{(212-106)g×10\% }=\frac {100}{m}=\frac {117}{n}$
$m=10g,n=11.7g$
$m_{溶液}=100g+212g-4.4g-10g=297.6g$
$NaCl\% =\frac {11.7g+11.7g}{297.6g}×100\% =7.9\% $
查看更多完整答案,请扫码查看


