2025年点石成金金牌夺冠九年级化学全一册人教版大连专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年点石成金金牌夺冠九年级化学全一册人教版大连专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第68页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
12. 科学探究与实践 金属活动性顺序及回收利用(10分)某实验小组同学在学习金属活动性顺序后,想要探究锰、锌、铜三种金属的活动性顺序,请你参与他们的实验探究。
【实验目的】探究锰、锌、铜三种金属的活动性顺序。
【询问老师】锰在溶液中以Mn²⁺形式存在,溶液颜色通常为浅肉色。
【设计并进行实验】
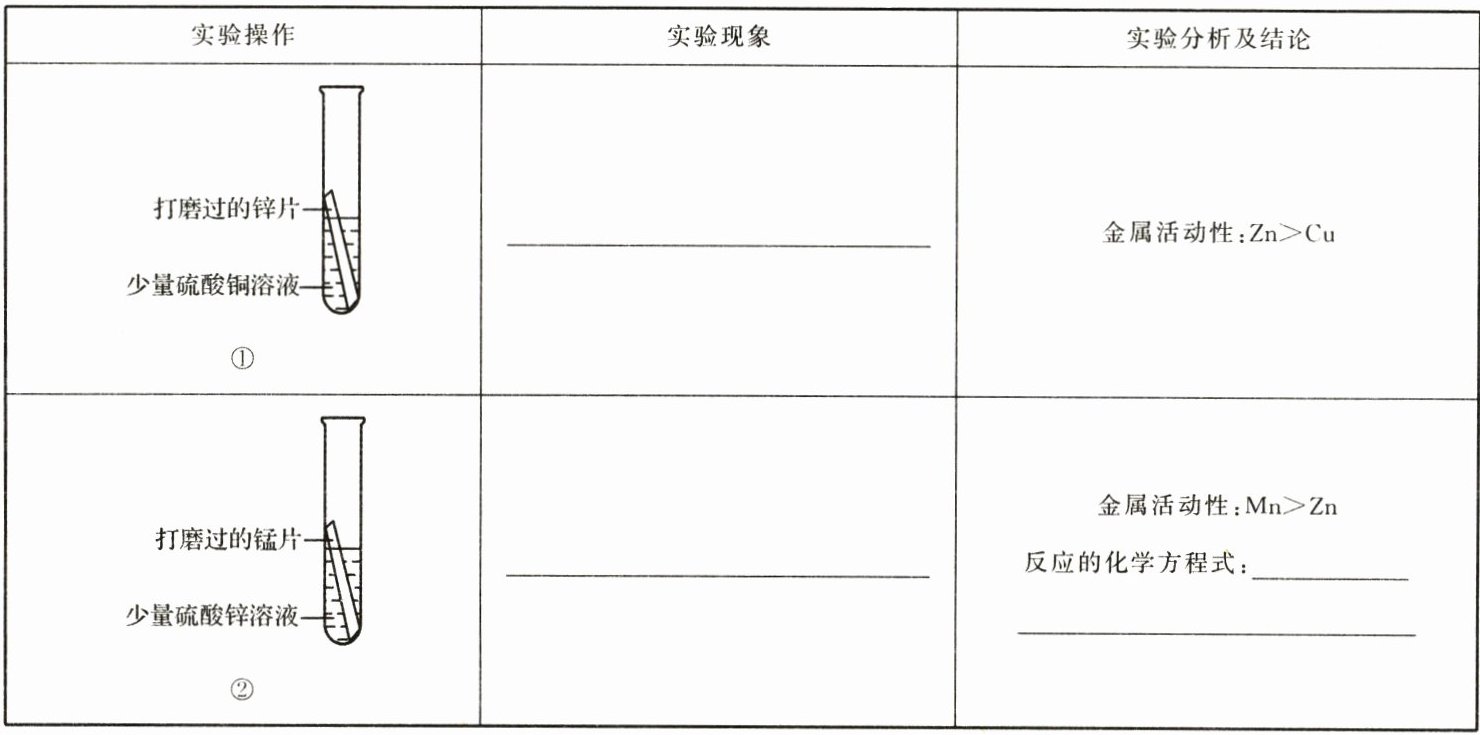
【实验结论】锰、锌、铜三种金属的活动性顺序是Mn>Zn>Cu。
【回收利用】该兴趣小组的同学从实验室收集了一桶含有ZnSO₄、CuSO₄的废液,他们想从中回收金属铜和硫酸锌晶体,设计实验方案如图1所示:

(1)操作Ⅰ中所需的玻璃仪器有 。
(2)甲同学认为金属X是Zn,乙同学认为金属X是Mn,你认为 (填“甲”或“乙”)同学的意见是正确的,理由是 。
(3)操作Ⅱ中加入适量稀硫酸的目的是 ,发生反应的化学方程式为 。
(4)根据流程图中的数据计算,金属混合物中Zn的质量为 g。
【实验拓展】小红同学将Mn、Zn分别放入等质量、等浓度的稀盐酸中,测得产生氢气的质量与反应时间的关系如图2所示。下列说法不正确的是 (填字母序号)。

A. 曲线a表示Mn与稀盐酸反应
B. 稀盐酸最终有剩余
C. 参与反应的Mn与Zn的质量比为11∶13
【实验目的】探究锰、锌、铜三种金属的活动性顺序。
【询问老师】锰在溶液中以Mn²⁺形式存在,溶液颜色通常为浅肉色。
【设计并进行实验】

【实验结论】锰、锌、铜三种金属的活动性顺序是Mn>Zn>Cu。
【回收利用】该兴趣小组的同学从实验室收集了一桶含有ZnSO₄、CuSO₄的废液,他们想从中回收金属铜和硫酸锌晶体,设计实验方案如图1所示:

(1)操作Ⅰ中所需的玻璃仪器有 。
(2)甲同学认为金属X是Zn,乙同学认为金属X是Mn,你认为 (填“甲”或“乙”)同学的意见是正确的,理由是 。
(3)操作Ⅱ中加入适量稀硫酸的目的是 ,发生反应的化学方程式为 。
(4)根据流程图中的数据计算,金属混合物中Zn的质量为 g。
【实验拓展】小红同学将Mn、Zn分别放入等质量、等浓度的稀盐酸中,测得产生氢气的质量与反应时间的关系如图2所示。下列说法不正确的是 (填字母序号)。

A. 曲线a表示Mn与稀盐酸反应
B. 稀盐酸最终有剩余
C. 参与反应的Mn与Zn的质量比为11∶13
答案:
【设计并进行实验】①有红色固体析出,溶液由蓝色变为无色
②有黑色固体析出,溶液由无色变为浅肉色
$Mn + ZnSO_{4}=MnSO_{4}+Zn$
【回收利用】
(1)漏斗、玻璃棒、烧杯
(2)甲 若金属X是Mn,Mn能将$ZnSO_{4}$和$CuSO_{4}$中的Zn和Cu置换出来,导致滤液中引入$MnSO_{4}$杂质,结晶后不能得到纯净的$ZnSO_{4}$
(3)除去金属混合物中的Zn
$Zn + H_{2}SO_{4}=ZnSO_{4}+H_{2}\uparrow$
(4)3.5
【实验拓展】B
【解析】【设计并进行实验】②由实验结论可知,金属活动性:$Mn>Zn$,则Mn能把Zn从其化合物溶液中置换出来。
【回收利用】
(4)设参加反应的Zn的质量为x。
$Zn + CuSO_{4}=ZnSO_{4}+Cu$
65 64
x 6.4 g
$\frac{65}{64}=\frac{x}{6.4 g}$
x = 6.5 g
金属混合物中Zn的质量为10 g - 6.5 g = 3.5 g。
【实验拓展】每55份质量的Mn与稀盐酸反应,会产生2份质量的$H_{2}$,每65份质量的Zn与稀盐酸反应,会产生2份质量的$H_{2}$,即产生相同质量的$H_{2}$,消耗Mn的质量更少。由图像可知,产生相同质量的$H_{2}$,曲线a消耗金属的质量更少,即曲线a表示Mn与稀盐酸反应,故A正确;随着金属质量的增加,最终产生氢气的质量不变,说明稀盐酸已经反应完全,参加反应的Mn与Zn的质量比为55:65 = 11:13,故B错误、C正确。
②有黑色固体析出,溶液由无色变为浅肉色
$Mn + ZnSO_{4}=MnSO_{4}+Zn$
【回收利用】
(1)漏斗、玻璃棒、烧杯
(2)甲 若金属X是Mn,Mn能将$ZnSO_{4}$和$CuSO_{4}$中的Zn和Cu置换出来,导致滤液中引入$MnSO_{4}$杂质,结晶后不能得到纯净的$ZnSO_{4}$
(3)除去金属混合物中的Zn
$Zn + H_{2}SO_{4}=ZnSO_{4}+H_{2}\uparrow$
(4)3.5
【实验拓展】B
【解析】【设计并进行实验】②由实验结论可知,金属活动性:$Mn>Zn$,则Mn能把Zn从其化合物溶液中置换出来。
【回收利用】
(4)设参加反应的Zn的质量为x。
$Zn + CuSO_{4}=ZnSO_{4}+Cu$
65 64
x 6.4 g
$\frac{65}{64}=\frac{x}{6.4 g}$
x = 6.5 g
金属混合物中Zn的质量为10 g - 6.5 g = 3.5 g。
【实验拓展】每55份质量的Mn与稀盐酸反应,会产生2份质量的$H_{2}$,每65份质量的Zn与稀盐酸反应,会产生2份质量的$H_{2}$,即产生相同质量的$H_{2}$,消耗Mn的质量更少。由图像可知,产生相同质量的$H_{2}$,曲线a消耗金属的质量更少,即曲线a表示Mn与稀盐酸反应,故A正确;随着金属质量的增加,最终产生氢气的质量不变,说明稀盐酸已经反应完全,参加反应的Mn与Zn的质量比为55:65 = 11:13,故B错误、C正确。
查看更多完整答案,请扫码查看


