2025年点石成金金牌夺冠九年级化学全一册人教版大连专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年点石成金金牌夺冠九年级化学全一册人教版大连专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第35页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
11. 科学探究与实践质量守恒定律(14分)从宏观、微观、符号相结合的视角探究物质及其变化规律是化学独
特的研究方法。请回答下列问题:
(一)宏观辨识−验证质量守恒定律
化学小组同学设计如图1所示四组实验验证质量守恒定律。
[查阅资料]碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳气体。
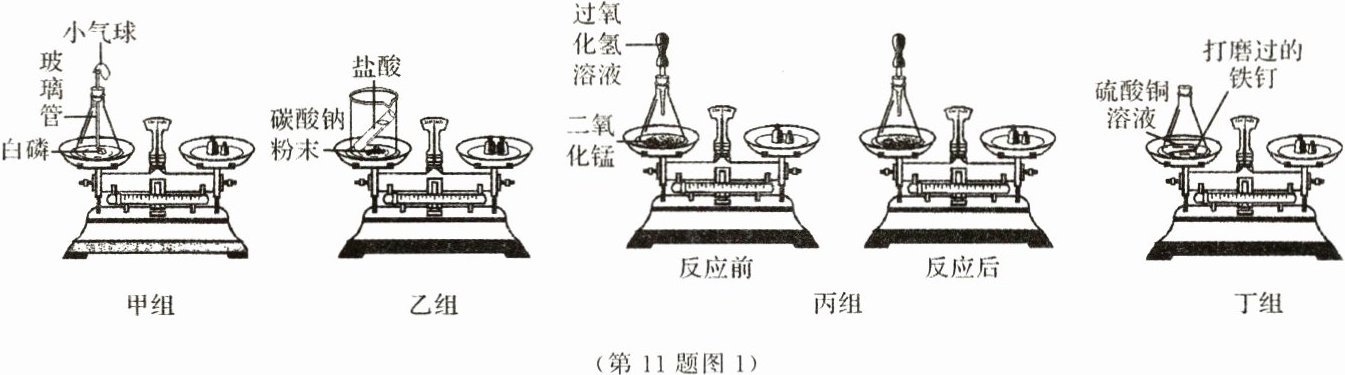
(1)①甲组实验中,白磷燃烧时,在锥形瓶底部加入少量水,其目的是______________________________。
②甲组检查装置气密性良好后,将装有白磷的装置放在托盘天平上称量的质量为m₁g,取下装置,点燃
白磷,若燃烧结束后,未待装置冷却就直接称量的质量为m₂g,则m₁________m₂(填“>”"<”或"=”)。
③甲组实验中,当白磷燃烧时观察到小气球的变化现象为________(填“变瘪”或“膨胀”),当实验结束后
发现小气球与初始状态相比________(填“相同”"变瘪”或"膨胀”)。
(2)请根据乙组和丙组设计的实验装置进行探究,并回答下列问题。
①乙组实验结束后可观察到天平________(填“平衡”或“不平衡”),原因是______________________________。
②丙组对过氧化氢溶液分解反应前后各物质质量总和进行测定,得出参加化学反应的各物质的质量总
和________(填“大于”"小于”或“等于”)反应后生成的各物质的质量总和。
(3)丁组实验中,将打磨过的铁钉浸到硫酸铜溶液中,充分反应后,观察到托盘天平的指针________(填
“向左”“向右”或“不”偏转,反应的化学方程式为______________________________。
(二)微观探析一−反应前后质量守恒实质
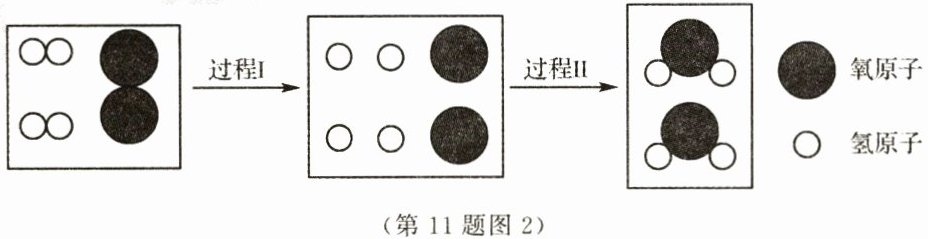
(4)如图2是氢气在空气中燃烧的微观示意图,该反应的基本反应类型为________反应。从微观角度分
析,过程I表示分子分解成________的过程。
(三)符号表征分析
(5)氢化镁(MgH₂)固体是一种很有发展前景的贮氢材料,能与水反应生成氢氧化镁和一种常见的气体,
反应的化学方程式为:MgH₂+2H₂O\xlongequal{\;}Mg(OH)₂+________↑。请补全该反应的化学方程式并写出
补全依据。
依据一:化学反应前后原子的种类和________________不变。
依据二:______________________________。
特的研究方法。请回答下列问题:
(一)宏观辨识−验证质量守恒定律
化学小组同学设计如图1所示四组实验验证质量守恒定律。
[查阅资料]碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳气体。

(1)①甲组实验中,白磷燃烧时,在锥形瓶底部加入少量水,其目的是______________________________。
②甲组检查装置气密性良好后,将装有白磷的装置放在托盘天平上称量的质量为m₁g,取下装置,点燃
白磷,若燃烧结束后,未待装置冷却就直接称量的质量为m₂g,则m₁________m₂(填“>”"<”或"=”)。
③甲组实验中,当白磷燃烧时观察到小气球的变化现象为________(填“变瘪”或“膨胀”),当实验结束后
发现小气球与初始状态相比________(填“相同”"变瘪”或"膨胀”)。
(2)请根据乙组和丙组设计的实验装置进行探究,并回答下列问题。
①乙组实验结束后可观察到天平________(填“平衡”或“不平衡”),原因是______________________________。
②丙组对过氧化氢溶液分解反应前后各物质质量总和进行测定,得出参加化学反应的各物质的质量总
和________(填“大于”"小于”或“等于”)反应后生成的各物质的质量总和。
(3)丁组实验中,将打磨过的铁钉浸到硫酸铜溶液中,充分反应后,观察到托盘天平的指针________(填
“向左”“向右”或“不”偏转,反应的化学方程式为______________________________。
(二)微观探析一−反应前后质量守恒实质
(4)如图2是氢气在空气中燃烧的微观示意图,该反应的基本反应类型为________反应。从微观角度分
析,过程I表示分子分解成________的过程。

(三)符号表征分析
(5)氢化镁(MgH₂)固体是一种很有发展前景的贮氢材料,能与水反应生成氢氧化镁和一种常见的气体,
反应的化学方程式为:MgH₂+2H₂O\xlongequal{\;}Mg(OH)₂+________↑。请补全该反应的化学方程式并写出
补全依据。
依据一:化学反应前后原子的种类和________________不变。
依据二:______________________________。
答案:
(一)
(1)①吸收白磷燃烧时放出的热量,让装置快速冷却,同时防止锥形瓶受热不均而炸裂
②> ③膨胀 变瘪
(2)①不平衡 生成的气体逸散到空气中
②等于
(3)不 $Fe + CuSO_{4} = FeSO_{4} + Cu$
(二)
(4)化合 原子
(三)
(5)$2H_{2}$ 依据一:数目
依据二:每个氢分子由2个氢原子构成
【解析】任务一:
(1)②燃烧结束后,未待装置冷却直接称量,左侧小气球处于膨胀状态,由于浮力的影响,导致反应后天平示数变小,即$m_{1}>m_{2}$。
(1)①吸收白磷燃烧时放出的热量,让装置快速冷却,同时防止锥形瓶受热不均而炸裂
②> ③膨胀 变瘪
(2)①不平衡 生成的气体逸散到空气中
②等于
(3)不 $Fe + CuSO_{4} = FeSO_{4} + Cu$
(二)
(4)化合 原子
(三)
(5)$2H_{2}$ 依据一:数目
依据二:每个氢分子由2个氢原子构成
【解析】任务一:
(1)②燃烧结束后,未待装置冷却直接称量,左侧小气球处于膨胀状态,由于浮力的影响,导致反应后天平示数变小,即$m_{1}>m_{2}$。
12. 科学探究与实践质量守恒定律的理解及应用(7分)质量守恒定律是化学学习中的重要定律,它不仅反映化学变化过程中各物质的质量关系,同时也是书写化学方程式的理论依据。
[定量分析]理解质量守恒定律
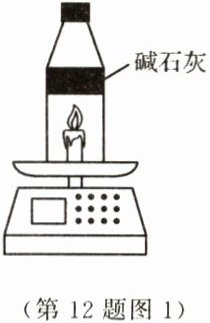
I. 将一根蜡烛放在电子秤上,点燃后记录数据,一段时间后示数变小。
II. 如图1,将另一根蜡烛点燃后,立即在火焰上方罩一个塑料瓶(底部已剪掉,内部填充有足量的碱石灰,可吸收二氧化碳和水),记录数据,发现示数不断增大。
(1)石蜡的化学式可用CₓHᵧ表示,石蜡在空气中燃烧生成的二氧化碳和水的分子个数比为________。
(2)实验I中减少的质量是______________的质量,实验II中增加的质量是______________的质量。
(3)分析以上两个实验可知,要验证质量守恒定律,反应通常应在________容器内进行。
[能力提升]依据质量守恒定律书写化学方程式
(4)镁能和氧气反应,还能和氮气在点燃的条件下反应生成氮化镁(氮化镁中氮元素显−3价),请写出镁与氮气反应的化学方程式:______________________________。
[拓展延伸]图像分析
(5)镁带在一充满氧气的密闭容器中完全燃烧后生成氧化镁,其固体质量变化如图2
所示,则(M₂−M₁)表示的质量是________(填字母序号)。
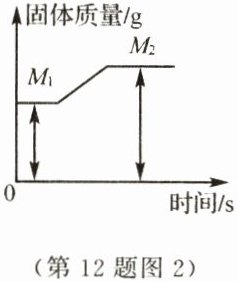
A. 生成MgO的质量
B. Mg的质量
C. 参加反应的O₂的质量
D. 多余的O₂的质量
[实际应用]化学式的判断
(6)“绿色化学"能实现零排放,即反应物中的原子利用率达到100%,原料全部转化为产品。CO和H₂ 在一定条件下按照不同的比例可以合成不同的有机化工原料。根据零排放的要求,以CO和H₂合成的有机物不可能是下列物质中的________(填字母序号)。
A. 甲醇(CH₄O) B. 乙醇(C₂H₆O) C. 甲醛(CH₂O) D. 乙酸(C₂H₄O₂)
[定量分析]理解质量守恒定律

I. 将一根蜡烛放在电子秤上,点燃后记录数据,一段时间后示数变小。
II. 如图1,将另一根蜡烛点燃后,立即在火焰上方罩一个塑料瓶(底部已剪掉,内部填充有足量的碱石灰,可吸收二氧化碳和水),记录数据,发现示数不断增大。
(1)石蜡的化学式可用CₓHᵧ表示,石蜡在空气中燃烧生成的二氧化碳和水的分子个数比为________。
(2)实验I中减少的质量是______________的质量,实验II中增加的质量是______________的质量。
(3)分析以上两个实验可知,要验证质量守恒定律,反应通常应在________容器内进行。
[能力提升]依据质量守恒定律书写化学方程式
(4)镁能和氧气反应,还能和氮气在点燃的条件下反应生成氮化镁(氮化镁中氮元素显−3价),请写出镁与氮气反应的化学方程式:______________________________。
[拓展延伸]图像分析
(5)镁带在一充满氧气的密闭容器中完全燃烧后生成氧化镁,其固体质量变化如图2
所示,则(M₂−M₁)表示的质量是________(填字母序号)。

A. 生成MgO的质量
B. Mg的质量
C. 参加反应的O₂的质量
D. 多余的O₂的质量
[实际应用]化学式的判断
(6)“绿色化学"能实现零排放,即反应物中的原子利用率达到100%,原料全部转化为产品。CO和H₂ 在一定条件下按照不同的比例可以合成不同的有机化工原料。根据零排放的要求,以CO和H₂合成的有机物不可能是下列物质中的________(填字母序号)。
A. 甲醇(CH₄O) B. 乙醇(C₂H₆O) C. 甲醛(CH₂O) D. 乙酸(C₂H₄O₂)
答案:
(1)$2x:y$
(2)参加反应的石蜡 参加反应的氧气
(3)密闭
(4)$3Mg + N_{2}\xlongequal{点燃}Mg_{3}N_{2}$
(5)C
(6)B
【解析】
(5)镁带在氧气中燃烧的化学方程式为$2Mg + O_{2}\xlongequal{点燃}2MgO$。由图可知,$M_{1}$表示反应前固体的质量,即镁带的质量,$M_{2}$表示反应后固体的质量,即氧化镁的质量,则$M_{2}-M_{1}$表示的是参加反应的$O_{2}$的质量,故C正确。
(6)“绿色化学”能实现零排放,即反应物中的原子利用率达到100%,原料全部转化为产品,说明反应类型一般是化合反应。$CO$和$H_{2}$在一定条件下发生反应,假设二者反应的化学计量数之比为$x:y$,则生成物只要满足$(CO)_{x}(H_{2})_{y}$的形式均正确。甲醇$(CH_{4}O)$可以转化为$(CO)_{1}(H_{2})_{2}$,故A正确;乙醇$(C_{2}H_{6}O)$不能转化为$(CO)_{x}(H_{2})_{y}$的形式,故B错误;甲醛$(CH_{2}O)$可转化为$(CO)_{1}(H_{2})_{1}$,故C正确;乙酸$(C_{2}H_{4}O_{2})$可转化为$(CO)_{2}(H_{2})_{2}$,故D正确。
(1)$2x:y$
(2)参加反应的石蜡 参加反应的氧气
(3)密闭
(4)$3Mg + N_{2}\xlongequal{点燃}Mg_{3}N_{2}$
(5)C
(6)B
【解析】
(5)镁带在氧气中燃烧的化学方程式为$2Mg + O_{2}\xlongequal{点燃}2MgO$。由图可知,$M_{1}$表示反应前固体的质量,即镁带的质量,$M_{2}$表示反应后固体的质量,即氧化镁的质量,则$M_{2}-M_{1}$表示的是参加反应的$O_{2}$的质量,故C正确。
(6)“绿色化学”能实现零排放,即反应物中的原子利用率达到100%,原料全部转化为产品,说明反应类型一般是化合反应。$CO$和$H_{2}$在一定条件下发生反应,假设二者反应的化学计量数之比为$x:y$,则生成物只要满足$(CO)_{x}(H_{2})_{y}$的形式均正确。甲醇$(CH_{4}O)$可以转化为$(CO)_{1}(H_{2})_{2}$,故A正确;乙醇$(C_{2}H_{6}O)$不能转化为$(CO)_{x}(H_{2})_{y}$的形式,故B错误;甲醛$(CH_{2}O)$可转化为$(CO)_{1}(H_{2})_{1}$,故C正确;乙酸$(C_{2}H_{4}O_{2})$可转化为$(CO)_{2}(H_{2})_{2}$,故D正确。
查看更多完整答案,请扫码查看


