2025年点石成金金牌夺冠九年级化学全一册人教版大连专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年点石成金金牌夺冠九年级化学全一册人教版大连专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第51页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
11.科学探究与实践二氧化碳的制取与应用(14分)CO₂是一种常见的气体,人类对CO₂的制取和应用的探
索从未止步。
(一)古代制取二氧化碳
(1)中国西晋时期的张华在所著的《博物志》中记载了一种在烧白石(CaCO₃)作白灰过程中产生CO₂气
体的方法。这里的“白灰”是________。
(二)实验室制取二氧化碳
(2)实验室制备并收集二氧化碳,按下表进行实验,取等质量的同种大理石加入足量酸中(杂质不与酸反
应),产生二氧化碳气体体积随时间变化曲线如图1所示,下列说法不正确的是________(填字母序号)。

A.实验III对应的变化曲线为甲
B.实验II和III对比,说明影响反应速率的因素是固体的颗粒大小
C.实验I和II对比,说明影响反应速率的因素是酸的浓度
D.实验II和III完全反应后,产生二氧化碳的质量是相等的
(3)图2中适合在实验室用大理石和稀盐酸制取CO₂的发生装置是________(填字母序号)。实验室常
采用D装置收集CO₂,而很少采用C装置,原因是______________________________。
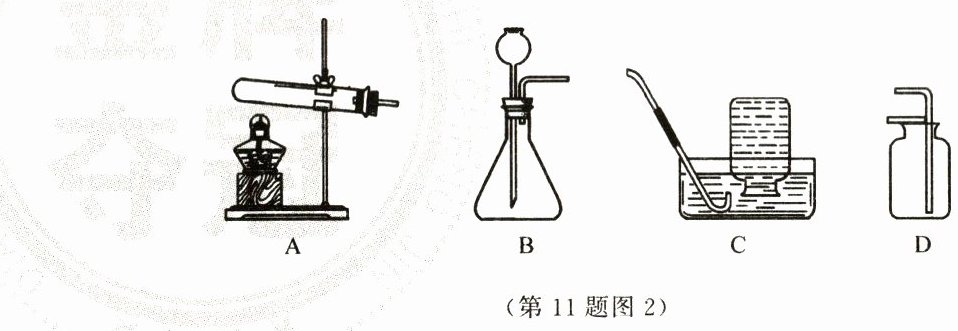
(4)用所选的装置制取较多的二氧化碳,从便于操作及回收和节约药品等角度考虑,最好一次性加入足
量的________(填药品名称)。
(5)A装置中,用酒精灯给试管预热的操作方法是______________________________;使用B装置
制气体时,长颈漏斗末端需要浸入锥形瓶中的液体,原因是______________________________。
(三)定量计算
(6)取25g含碳酸钙80%的大理石与足量稀盐酸反应,理论上最多能生成二氧化碳质量是__________g,
但实际收集到的二氧化碳气体却偏少,可能的一条原因是______________________________。
(四)特定条件制取二氧化碳
(7)合成气法:在催化剂作用下,CO与H₂O发生反应生成CO₂和H₂,该反应的化学方程式为________。
(8)吸附精馏法:吸附精馏法采用硅胶、3A分子筛和活性炭作吸附剂,脱除部分杂质,精馏后可制取高纯度二氧化碳。活性炭可以作吸附剂是因为它具有______________的结构。
(五)二氧化碳的应用
(9)利用CO₂制取O₂:CO₂常被用作空气再生装置的反应物,利用CO₂与过氧化钠(Na₂O₂)反应制取O₂。Na₂O₂中钠元素的化合价为+1,则氧元素的化合价为________。
(10)利用CO₂进行爆破:将液态CO₂压缩至圆柱体(爆破筒)内,利用微电流经过导热棒产生的高温瞬间将液态CO₂汽化,急剧膨胀产生高压致使岩体裂开。请从分子角度解释CO₂气体可以被压缩为液体的原因是______________________________。
(六)探究二氧化碳的减排和消耗
(11)我国努力争取2060年前实现“碳中和”,体现大国担当。人类降低空气中二氧化碳含量的策略有两个:一是减少二氧化碳的排放,比如少开燃油车出行。二是增加二氧化碳的消耗,请写出一条消耗二氧化碳的方式或途径:______________________________。
索从未止步。
(一)古代制取二氧化碳
(1)中国西晋时期的张华在所著的《博物志》中记载了一种在烧白石(CaCO₃)作白灰过程中产生CO₂气
体的方法。这里的“白灰”是________。
(二)实验室制取二氧化碳
(2)实验室制备并收集二氧化碳,按下表进行实验,取等质量的同种大理石加入足量酸中(杂质不与酸反
应),产生二氧化碳气体体积随时间变化曲线如图1所示,下列说法不正确的是________(填字母序号)。

A.实验III对应的变化曲线为甲
B.实验II和III对比,说明影响反应速率的因素是固体的颗粒大小
C.实验I和II对比,说明影响反应速率的因素是酸的浓度
D.实验II和III完全反应后,产生二氧化碳的质量是相等的
(3)图2中适合在实验室用大理石和稀盐酸制取CO₂的发生装置是________(填字母序号)。实验室常
采用D装置收集CO₂,而很少采用C装置,原因是______________________________。

(4)用所选的装置制取较多的二氧化碳,从便于操作及回收和节约药品等角度考虑,最好一次性加入足
量的________(填药品名称)。
(5)A装置中,用酒精灯给试管预热的操作方法是______________________________;使用B装置
制气体时,长颈漏斗末端需要浸入锥形瓶中的液体,原因是______________________________。
(三)定量计算
(6)取25g含碳酸钙80%的大理石与足量稀盐酸反应,理论上最多能生成二氧化碳质量是__________g,
但实际收集到的二氧化碳气体却偏少,可能的一条原因是______________________________。
(四)特定条件制取二氧化碳
(7)合成气法:在催化剂作用下,CO与H₂O发生反应生成CO₂和H₂,该反应的化学方程式为________。
(8)吸附精馏法:吸附精馏法采用硅胶、3A分子筛和活性炭作吸附剂,脱除部分杂质,精馏后可制取高纯度二氧化碳。活性炭可以作吸附剂是因为它具有______________的结构。
(五)二氧化碳的应用
(9)利用CO₂制取O₂:CO₂常被用作空气再生装置的反应物,利用CO₂与过氧化钠(Na₂O₂)反应制取O₂。Na₂O₂中钠元素的化合价为+1,则氧元素的化合价为________。
(10)利用CO₂进行爆破:将液态CO₂压缩至圆柱体(爆破筒)内,利用微电流经过导热棒产生的高温瞬间将液态CO₂汽化,急剧膨胀产生高压致使岩体裂开。请从分子角度解释CO₂气体可以被压缩为液体的原因是______________________________。
(六)探究二氧化碳的减排和消耗
(11)我国努力争取2060年前实现“碳中和”,体现大国担当。人类降低空气中二氧化碳含量的策略有两个:一是减少二氧化碳的排放,比如少开燃油车出行。二是增加二氧化碳的消耗,请写出一条消耗二氧化碳的方式或途径:______________________________。
答案:
(一)
(1)氧化钙
(二)
(2)C
(3)B 二氧化碳的密度大于空气、能溶于水且与水反应
(4)大理石
(5)用酒精灯的外焰在试管下方来回移动 防止产生的气体从长颈漏斗逸散到空气中
(三)
(6)8.8 装置漏气(或部分二氧化碳残留在发生装置内)
(四)
(7)$CO + H_{2}O\stackrel{催化剂}{=\!=\!=}CO_{2} + H_{2}$
(8)疏松多孔
(五)
(9)-1
(10)二氧化碳分子间有间隔,压强增大,分子间的间隔缩小
(六)
(11)植树造林(合理即可)
【解析】
(2)大理石的主要成分是碳酸钙,发生反应的化学方程式为$CaCO_{3} + 2HCl = CaCl_{2} + H_{2}O + CO_{2}\uparrow$,实验Ⅰ中,大理石和稀硫酸反应会生成微溶于水的硫酸钙,覆盖在大理石的表面,阻碍反应的进行,反应产生二氧化碳的体积最少,所以实验Ⅰ对应的变化曲线为丙;实验Ⅱ中,产生二氧化碳的速率适中,所以实验Ⅱ对应的变化曲线为乙;实验Ⅲ中,大理石是粉末状,反应速率最快,所以实验Ⅲ对应的变化曲线为甲,故A正确;实验Ⅱ、Ⅲ的变量是大理石的颗粒大小,所以实验Ⅱ和Ⅲ对比,可以说明影响反应速率的因素是固体的颗粒大小,故B正确;实验Ⅰ、Ⅱ所用酸的种类不同,无法说明影响反应速率的因素是酸的浓度,故C错误;实验Ⅱ、Ⅲ的药品用量相同,所以产生的二氧化碳的质量相等,故D正确。
(6)设生成二氧化碳的质量为$x$。
$CaCO_{3} + 2HCl = CaCl_{2} + CO_{2}\uparrow + H_{2}O$
100 44
$25 g×80\%$ $x$
$\frac{100}{44} = \frac{25 g×80\%}{x}$
$x = 8.8 g$
(1)氧化钙
(二)
(2)C
(3)B 二氧化碳的密度大于空气、能溶于水且与水反应
(4)大理石
(5)用酒精灯的外焰在试管下方来回移动 防止产生的气体从长颈漏斗逸散到空气中
(三)
(6)8.8 装置漏气(或部分二氧化碳残留在发生装置内)
(四)
(7)$CO + H_{2}O\stackrel{催化剂}{=\!=\!=}CO_{2} + H_{2}$
(8)疏松多孔
(五)
(9)-1
(10)二氧化碳分子间有间隔,压强增大,分子间的间隔缩小
(六)
(11)植树造林(合理即可)
【解析】
(2)大理石的主要成分是碳酸钙,发生反应的化学方程式为$CaCO_{3} + 2HCl = CaCl_{2} + H_{2}O + CO_{2}\uparrow$,实验Ⅰ中,大理石和稀硫酸反应会生成微溶于水的硫酸钙,覆盖在大理石的表面,阻碍反应的进行,反应产生二氧化碳的体积最少,所以实验Ⅰ对应的变化曲线为丙;实验Ⅱ中,产生二氧化碳的速率适中,所以实验Ⅱ对应的变化曲线为乙;实验Ⅲ中,大理石是粉末状,反应速率最快,所以实验Ⅲ对应的变化曲线为甲,故A正确;实验Ⅱ、Ⅲ的变量是大理石的颗粒大小,所以实验Ⅱ和Ⅲ对比,可以说明影响反应速率的因素是固体的颗粒大小,故B正确;实验Ⅰ、Ⅱ所用酸的种类不同,无法说明影响反应速率的因素是酸的浓度,故C错误;实验Ⅱ、Ⅲ的药品用量相同,所以产生的二氧化碳的质量相等,故D正确。
(6)设生成二氧化碳的质量为$x$。
$CaCO_{3} + 2HCl = CaCl_{2} + CO_{2}\uparrow + H_{2}O$
100 44
$25 g×80\%$ $x$
$\frac{100}{44} = \frac{25 g×80\%}{x}$
$x = 8.8 g$
查看更多完整答案,请扫码查看


