第16页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
1. 在20℃时,10 g水中最多溶解3.6 g氯化钠固体。则20℃时氯化钠的溶解性为 ( )
A. 易溶
B. 微溶
C. 可溶
D. 难溶
A. 易溶
B. 微溶
C. 可溶
D. 难溶
答案:
A
2. 20℃时,50 g水中最多能溶解10 g A物质,10 g酒精中最多能溶解4 g B物质,则A和B的溶解度相比 ( )
A. 2A = B
B. A > B
C. A < B
D. 无法比较
A. 2A = B
B. A > B
C. A < B
D. 无法比较
答案:
D
3.(2023·河北)20℃和60℃时KCl的溶解度分别为34.0 g和45.5 g,如图所示为对KCl进行的溶解实验。下列分析错误的是( )
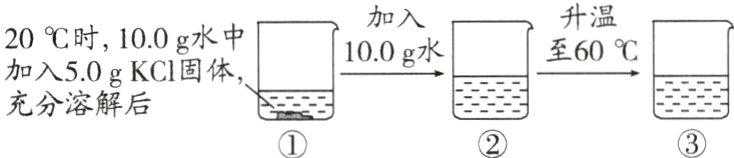
A. ①中溶液为KCl的饱和溶液
B. ②中溶液的质量为25.0 g
C. 溶液中溶质的质量:①<② = ③
D. 溶液中溶质的质量分数:①<② = ③

A. ①中溶液为KCl的饱和溶液
B. ②中溶液的质量为25.0 g
C. 溶液中溶质的质量:①<② = ③
D. 溶液中溶质的质量分数:①<② = ③
答案:
D 解析:20℃KCl的溶解度为34.0g,则20℃时10g水中最多能溶解3.4g氯化钾,则①中溶液为KCl的饱和溶液,A正确;20℃KCl的溶解度为34.0g,则20℃时20g水中最多能溶解氯化钾6.8g,则5.0g氯化钾能全部溶解,②中溶液的质量为5.0g+20.0g=25.0g,B正确;由图示可知,溶液中溶质的质量:①<②=③,C正确;①是20℃KCl 的饱和溶液,②是20℃KCl的不饱和溶液,则溶质质量分数:①>②;②、③中溶质和溶剂的质量均相等,则溶液中溶质的质量分数:①>②=③,D错误。
4.(2024·连云港中考)我国盐湖地区有“夏天晒盐(NaCl),冬天捞碱(Na₂CO₃)”的做法。NaCl、Na₂CO₃的溶解度曲线如图所示。下列说法中正确的是 ( )
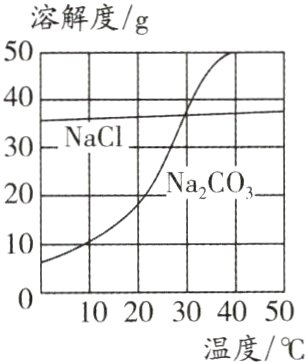
A. 20℃时Na₂CO₃的饱和溶液,升温到40℃时仍是饱和溶液
B. 30℃时,在100 g水中加入40 g NaCl,形成不饱和溶液
C. NaCl的溶解度比Na₂CO₃的大
D. “夏天晒盐”经过蒸发结晶过程,“冬天捞碱”经过降温结晶过程

A. 20℃时Na₂CO₃的饱和溶液,升温到40℃时仍是饱和溶液
B. 30℃时,在100 g水中加入40 g NaCl,形成不饱和溶液
C. NaCl的溶解度比Na₂CO₃的大
D. “夏天晒盐”经过蒸发结晶过程,“冬天捞碱”经过降温结晶过程
答案:
D 解析:20℃时碳酸钠的饱和溶液升温至40℃,升温后,碳酸钠的溶解度增大,变为不饱和溶液,A错误;30℃时,氯化钠的溶解度小于40g,则该温度下,在100g水中加入40g氯化钠,氯化钠部分溶解,形成的是饱和溶液,B错误;比较溶解度,应指明温度,否则无法比较,C错误;由题图可知,碳酸钠和氯化钠的溶解度均随温度的升高而增大,碳酸钠的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小,故“夏天晒盐”通过蒸发结晶获得氯化钠,“冬天捞碱”通过降温结晶得到碳酸钠,D正确。
5.(2024·临沂中考)硝酸钾和氯化钠的溶解度曲线如图所示。请回答下列问题:

(1)t℃时,硝酸钾的溶解度______(填“>”“<”或“=”)氯化钠的溶解度。
(2)P点表示60℃时硝酸钾的______溶液(填“饱和”或“不饱和”)。
(3)60℃时,将60 g硝酸钾固体加入50 g水中,充分溶解,所得溶液中溶质与溶剂的质量比为______(填最简整数比)。

(1)t℃时,硝酸钾的溶解度______(填“>”“<”或“=”)氯化钠的溶解度。
(2)P点表示60℃时硝酸钾的______溶液(填“饱和”或“不饱和”)。
(3)60℃时,将60 g硝酸钾固体加入50 g水中,充分溶解,所得溶液中溶质与溶剂的质量比为______(填最简整数比)。
答案:
(1)=
(2)不饱和
(3)11:10
解析:
(1)由溶解度曲线可知,t℃时,硝酸钾的溶解度曲线和氯化钠的溶解度曲线相交于一点,即t℃时,硝酸钾的溶解度=氯化钠的溶解度。
(2)P点的溶液位于KNO₃溶解度曲线的下方区域,表示60℃时硝酸钾的不饱和溶液。
(3)60℃时,KNO₃的溶解度为110g,则60℃时,将60g硝酸钾固体加入50g水中,充分溶解,只有55g硝酸钾能够完全溶解,故所得溶液中溶质与溶剂的质量比为55g:50g=11:10
(1)=
(2)不饱和
(3)11:10
解析:
(1)由溶解度曲线可知,t℃时,硝酸钾的溶解度曲线和氯化钠的溶解度曲线相交于一点,即t℃时,硝酸钾的溶解度=氯化钠的溶解度。
(2)P点的溶液位于KNO₃溶解度曲线的下方区域,表示60℃时硝酸钾的不饱和溶液。
(3)60℃时,KNO₃的溶解度为110g,则60℃时,将60g硝酸钾固体加入50g水中,充分溶解,只有55g硝酸钾能够完全溶解,故所得溶液中溶质与溶剂的质量比为55g:50g=11:10
6. 新情境(2024·无锡一模)地球深处的水处于超临界状态,称为超临界水。如图为某压强下CaCl₂和NaCl在超临界水中的溶解度曲线。该压强下,下列说法正确的是 ( )
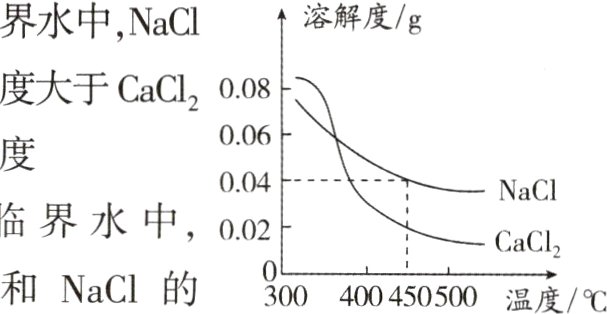
A. 在超临界水中,NaCl的溶解度大于CaCl₂的溶解度
B. 在超临界水中,CaCl₂和NaCl的溶解度都随温度升高而增大
C. 450℃时,将0.03 g NaCl溶于50 g超临界水中形成饱和溶液
D. 500℃时,NaCl的超临界水溶液一定比CaCl₂的超临界水溶液浓度高

A. 在超临界水中,NaCl的溶解度大于CaCl₂的溶解度
B. 在超临界水中,CaCl₂和NaCl的溶解度都随温度升高而增大
C. 450℃时,将0.03 g NaCl溶于50 g超临界水中形成饱和溶液
D. 500℃时,NaCl的超临界水溶液一定比CaCl₂的超临界水溶液浓度高
答案:
C 解析:在超临界水中,没有指明温度,NaCl的溶解度和CaCl₂的溶解度是无法比较的,A错误;由图像趋势可知,在超临界水中,CaCl₂和NaCl的溶解度都随温度升高而减小,B错误;由图像可知,在450℃时,NaCl的溶解度为0.04g,则50g超临界水中最多溶解0.02gNaCl,所以将0.03gNaCl溶于50g超临界水中形成饱和溶液,C正确;选项中并未指明NaCl的超临界水溶液和CaCl₂的超临界水溶液是否为饱和溶液,所以无法比较浓度,D错误。
查看更多完整答案,请扫码查看


