2026年高考一线课时练习高中化学必修第一册通用版江苏专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高考一线课时练习高中化学必修第一册通用版江苏专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第73页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
典例2 某化学实验小组同学为了证明、比较$\mathrm{SO_2}$和氯水的漂白性,设计了如图所示的实验装置。
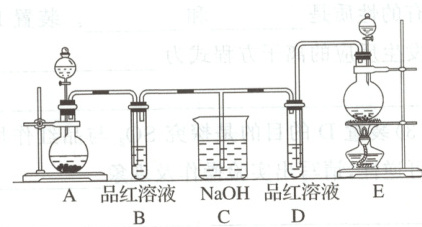
(1)实验室常选用制$\mathrm{CO_2}$的发生装置制$\mathrm{SO_2}$;实验室在用$\mathrm{MnO_2}$跟浓盐酸反应制备$\mathrm{Cl_2}$时,应选用上图A、E两发生装置中的
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为 B:
(3)装置C的作用是
(4)甲乙两名同学分别利用如图所示装置探究两种气体按不同比例混合后的漂白性,试分析:
$\mathrm{SO_2} \rightarrow$ $\mathrm{Cl_2} \leftarrow$
$\mathrm{Cl_2} \leftarrow$
浓硫酸 品红溶液 $\mathrm{NaOH}$溶液
①在气体进入品红溶液之前,先将$\mathrm{SO_2}$和$\mathrm{Cl_2}$通过盛有浓硫酸装置的目的是
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是
③乙同学在实验过程中发现:通气一段时间后,品红溶液颜色随时间推移变得越来越浅,其原因是
【思路点拨】解答本题需注意以下两点:
(1)注意$\mathrm{Cl_2}$与$\mathrm{SO_2}$的反应比例关系:$\mathrm{Cl_2}+\mathrm{SO_2}+2\mathrm{H_2O}=\mathrm{H_2SO_4}+2\mathrm{HCl}$。(2)熟记各类漂白剂的漂白原理。
[尝试解答]

(1)实验室常选用制$\mathrm{CO_2}$的发生装置制$\mathrm{SO_2}$;实验室在用$\mathrm{MnO_2}$跟浓盐酸反应制备$\mathrm{Cl_2}$时,应选用上图A、E两发生装置中的
E
装置(填装置序号)。在制$\mathrm{Cl_2}$的反应中浓盐酸所表现出的性质是还原性和酸性
。(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为 B:
溶液由无色变成红色
,D:溶液没有明显变化
。(3)装置C的作用是
保证安全,吸收多余的氯气和二氧化硫,防止污染空气
。(4)甲乙两名同学分别利用如图所示装置探究两种气体按不同比例混合后的漂白性,试分析:
$\mathrm{SO_2} \rightarrow$
 $\mathrm{Cl_2} \leftarrow$
$\mathrm{Cl_2} \leftarrow$浓硫酸 品红溶液 $\mathrm{NaOH}$溶液
①在气体进入品红溶液之前,先将$\mathrm{SO_2}$和$\mathrm{Cl_2}$通过盛有浓硫酸装置的目的是
使两种气体充分混合;通过观察气泡的速度控制气体流量,使二者按一定比例混合
。②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是
SO₂和Cl₂按1∶1进气,二者恰好完全反应,生成无漂白性的H₂SO₄和HCl
,并写出其相应的离子方程式:SO₂+Cl₂+2H₂O══4H⁺+SO₄²⁻+2Cl⁻
。③乙同学在实验过程中发现:通气一段时间后,品红溶液颜色随时间推移变得越来越浅,其原因是
SO₂和Cl₂的进气速度不相等,混合发生反应后其中一种气体有剩余,仍具有漂白性
。【思路点拨】解答本题需注意以下两点:
(1)注意$\mathrm{Cl_2}$与$\mathrm{SO_2}$的反应比例关系:$\mathrm{Cl_2}+\mathrm{SO_2}+2\mathrm{H_2O}=\mathrm{H_2SO_4}+2\mathrm{HCl}$。(2)熟记各类漂白剂的漂白原理。
[尝试解答]
答案:
(1)E 还原性和酸性
(2)溶液由无色变成红色 溶液没有明显变化
(3)保证安全,吸收多余的氯气和二氧化硫,防止污染空气
(4)①使两种气体充分混合;通过观察气泡的速度控制气体流量,使二者按一定比例混合 ②SO₂和Cl₂按1∶1进气,二者恰好完全反应,生成无漂白性的H₂SO₄和HCl SO₂+Cl₂+2H₂O══4H⁺+SO₄²⁻+2Cl⁻
③SO₂和Cl₂的进气速度不相等,混合发生反应后其中一种气体有剩余,仍具有漂白性
(1)E 还原性和酸性
(2)溶液由无色变成红色 溶液没有明显变化
(3)保证安全,吸收多余的氯气和二氧化硫,防止污染空气
(4)①使两种气体充分混合;通过观察气泡的速度控制气体流量,使二者按一定比例混合 ②SO₂和Cl₂按1∶1进气,二者恰好完全反应,生成无漂白性的H₂SO₄和HCl SO₂+Cl₂+2H₂O══4H⁺+SO₄²⁻+2Cl⁻
③SO₂和Cl₂的进气速度不相等,混合发生反应后其中一种气体有剩余,仍具有漂白性
3. 下列实验报告记录的实验现象正确的是(

A.无色 无现象 白色溶液
B.红色 白色沉淀 白色沉淀
C.红色 溶液变无色,白色沉淀 白色沉淀
D.无色 无色溶液 无色溶液
C
)
A.无色 无现象 白色溶液
B.红色 白色沉淀 白色沉淀
C.红色 溶液变无色,白色沉淀 白色沉淀
D.无色 无色溶液 无色溶液
答案:
3.C
1. 已知亚硫酸的酸性强于碳酸。$\mathrm{CO_2}$气体中含少量$\mathrm{SO_2}$,欲得到干燥纯净的$\mathrm{CO_2}$,通过如图所示的洗气瓶,①②两瓶中所装的试剂应该分别是 (
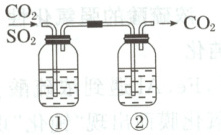
A.$\mathrm{NaOH}$、浓硫酸
B.浓硫酸、$\mathrm{NaOH}$
C.饱和$\mathrm{NaHCO_3}$、浓硫酸
D.浓硫酸、$\mathrm{Na_2CO_3}$
C
)
A.$\mathrm{NaOH}$、浓硫酸
B.浓硫酸、$\mathrm{NaOH}$
C.饱和$\mathrm{NaHCO_3}$、浓硫酸
D.浓硫酸、$\mathrm{Na_2CO_3}$
答案:
1.C
2. 将过量的$\mathrm{SO_2}$通入下列溶液中,最终溶液变浑浊或有沉淀生成的是 (
①$\mathrm{Ca(OH)_2}$
②$\mathrm{BaCl_2}$
③氢硫酸($\mathrm{H_2S}$)
④$\mathrm{Na_2CO_3}$
A.①②③
B.③
C.②
D.④
B
)①$\mathrm{Ca(OH)_2}$
②$\mathrm{BaCl_2}$
③氢硫酸($\mathrm{H_2S}$)
④$\mathrm{Na_2CO_3}$
A.①②③
B.③
C.②
D.④
答案:
2.B
查看更多完整答案,请扫码查看


