2025年世纪金榜新视野暑假作业高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年世纪金榜新视野暑假作业高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
15.下列关于硅及其化合物的说法,正确的是(
A.硅的导电性介于导体与绝缘体之间,是良好的半导体材料,可用于生产光导纤维
B.二氧化硅可用于生产计算机、家用电器等的芯片,及硅太阳能电池
C.高纯硅的制备:${SiO_{2}->[C]Si}$(粗)${->[HCl]SiHCl_{3}->[H_{2}]Si}$(纯),三步反应均为氧化还原反应
D.${Si->[][]SiO_{2}}$,${SiO_{2}->[][]H_{2}SiO_{3}}$、${SiO_{2}->[][]}$水玻璃,均能通过一步反应完成
C
)A.硅的导电性介于导体与绝缘体之间,是良好的半导体材料,可用于生产光导纤维
B.二氧化硅可用于生产计算机、家用电器等的芯片,及硅太阳能电池
C.高纯硅的制备:${SiO_{2}->[C]Si}$(粗)${->[HCl]SiHCl_{3}->[H_{2}]Si}$(纯),三步反应均为氧化还原反应
D.${Si->[][]SiO_{2}}$,${SiO_{2}->[][]H_{2}SiO_{3}}$、${SiO_{2}->[][]}$水玻璃,均能通过一步反应完成
答案:
高纯硅是良好的半导体材料,可用于生产计算机、家用电器等的芯片,及硅太阳能电池,A项错误;${SiO_{2}}$具有良好的导光性,可用于生产光导纤维,B项错误;高纯硅制备的主要反应为:${SiO_{2} + 2C\xlongequal{\text{高温}}Si(\text{粗}) + 2CO\uparrow }$,${Si(\text{粗}) + 3HCl\xlongequal{\triangle }SiHCl_{3} + H_{2}}$;${SiHCl_{3} + H_{2}\xlongequal{\text{高温}}Si(\text{纯}) + 3HCl}$,三个反应均为氧化还原反应,C项正确;${Si + O_{2}\xlongequal{\triangle }SiO_{2}}$,${SiO_{2}}$不溶于水,${SiO_{2}\to H_{2}SiO_{3}}$不能一步完成,${Na_{2}SiO_{3}}$的水溶液俗称水玻璃,${SiO_{2} + 2NaOH\xlongequal{\phantom{\rule[-.2em]{0ex}{0ex}}}Na_{2}SiO_{3} + H_{2}O}$,D项错误。
16.(16分)中国高铁建设中使用了很多先进的材料与技术。
(1)建设高铁轨道需要大量的水泥,生产水泥的主要原材料是黏土和
(2)高铁上的信息传输系统使用了光导纤维,其主要成分是
(3)高铁列车上安装有许多玻璃,氢氟酸可以处理玻璃表面的微裂纹,氢氟酸与玻璃中的二氧化硅反应的化学方程式为
(4)高铁上的卫生间没有任何异味,是由于所使用的马桶、地漏和洗手盆下水口都是纳米硅胶的高科技产品。向硅酸钠溶液中加入稀盐酸可产生硅酸胶体,该反应的离子方程式为
(1)建设高铁轨道需要大量的水泥,生产水泥的主要原材料是黏土和
石灰石
;还需要加入适量石膏
调节水泥硬化速率。(2)高铁上的信息传输系统使用了光导纤维,其主要成分是
${SiO_{2}}$
;乘务员使用的无线通话机的芯片材料是${Si}$
。(3)高铁列车上安装有许多玻璃,氢氟酸可以处理玻璃表面的微裂纹,氢氟酸与玻璃中的二氧化硅反应的化学方程式为
${SiO_{2} + 4HF\xlongequal{\phantom{\rule[-.2em]{0ex}{0ex}}}SiF_{4}\uparrow + 2H_{2}O}$
。(4)高铁上的卫生间没有任何异味,是由于所使用的马桶、地漏和洗手盆下水口都是纳米硅胶的高科技产品。向硅酸钠溶液中加入稀盐酸可产生硅酸胶体,该反应的离子方程式为
${SiO^{2-}_{3} + 2H^{+}\xlongequal{\phantom{\rule[-.2em]{0ex}{0ex}}}H_{2}SiO_{3}(\text{胶体})}$
。
答案:
(1)石灰石 石膏
(2)${SiO_{2}}$ ${Si}$
(3)${SiO_{2} + 4HF\xlongequal{\phantom{\rule[-.2em]{0ex}{0ex}}}SiF_{4}\uparrow + 2H_{2}O}$
(4)${SiO^{2-}_{3} + 2H^{+}\xlongequal{\phantom{\rule[-.2em]{0ex}{0ex}}}H_{2}SiO_{3}(\text{胶体})}$
(1)石灰石 石膏
(2)${SiO_{2}}$ ${Si}$
(3)${SiO_{2} + 4HF\xlongequal{\phantom{\rule[-.2em]{0ex}{0ex}}}SiF_{4}\uparrow + 2H_{2}O}$
(4)${SiO^{2-}_{3} + 2H^{+}\xlongequal{\phantom{\rule[-.2em]{0ex}{0ex}}}H_{2}SiO_{3}(\text{胶体})}$
17.(12分)硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)新型陶瓷${Si_{3}N_{4}}$的熔点高、硬度大、化学性质稳定。工业上可以采用化学气相沉积法,在${H_{2}}$的保护下,使${SiCl_{4}}与{N_{2}}反应生成{Si_{3}N_{4}}$沉积在石墨表面,写出该反应的化学方程式:
(2)一种工业用硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1 410℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的主要工艺流程如下:

①净化${N_{2}}和{H_{2}}$时,铜屑的作用是
②X可能是
(1)新型陶瓷${Si_{3}N_{4}}$的熔点高、硬度大、化学性质稳定。工业上可以采用化学气相沉积法,在${H_{2}}$的保护下,使${SiCl_{4}}与{N_{2}}反应生成{Si_{3}N_{4}}$沉积在石墨表面,写出该反应的化学方程式:
${3SiCl_{4} + 2N_{2} + 6H_{2}\xlongequal{\phantom{\rule[-.2em]{0ex}{0ex}}}Si_{3}N_{4} + 12HCl}$
。(2)一种工业用硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1 410℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的主要工艺流程如下:

①净化${N_{2}}和{H_{2}}$时,铜屑的作用是
除去原料气中的氧气
,硅胶的作用是除去水蒸气
。②X可能是
硝酸
(填“盐酸”“硝酸”“硫酸”或“氢氟酸”)。
答案:
(1)${3SiCl_{4} + 2N_{2} + 6H_{2}\xlongequal{\phantom{\rule[-.2em]{0ex}{0ex}}}Si_{3}N_{4} + 12HCl}$
(2)①除去原料气中的氧气 除去水蒸气 ②硝酸
(1)${3SiCl_{4} + 2N_{2} + 6H_{2}\xlongequal{\phantom{\rule[-.2em]{0ex}{0ex}}}Si_{3}N_{4} + 12HCl}$
(2)①除去原料气中的氧气 除去水蒸气 ②硝酸
18.(12分)硅单质及其化合物应用范围很广。请回答下列问题:制备硅半导体材料必须先得到高纯硅,三氯甲硅烷(${SiHCl_{3}}$)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
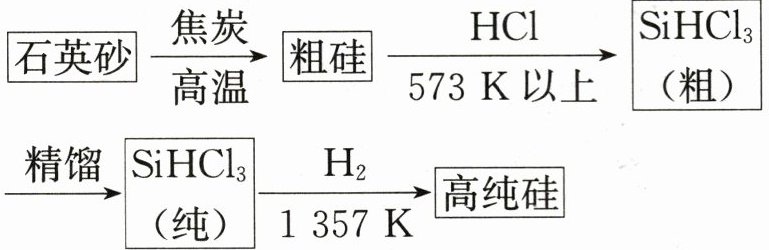
(1)写出由纯${SiHCl_{3}}$制备高纯硅的化学方程式:
(2)整个制备过程必须严格控制无水无氧。${SiHCl_{3}}遇水剧烈反应生成{H_{2}SiO_{3}}$、${HCl}$和另一种物质,写出这一过程的化学方程式:

(1)写出由纯${SiHCl_{3}}$制备高纯硅的化学方程式:
${SiHCl_{3} + H_{2}\xlongequal{1 357\;K}Si + 3HCl}$
。(2)整个制备过程必须严格控制无水无氧。${SiHCl_{3}}遇水剧烈反应生成{H_{2}SiO_{3}}$、${HCl}$和另一种物质,写出这一过程的化学方程式:
${SiHCl_{3} + 3H_{2}O\xlongequal{\phantom{\rule[-.2em]{0ex}{0ex}}}H_{2}SiO_{3}\downarrow + 3HCl + H_{2}\uparrow }$
;${H_{2}}还原{SiHCl_{3}}过程中若混入{O_{2}}$,可能引起的后果是 高温下${H_{2}}$与${O_{2}}$反应发生爆炸
。
答案:
(1)${SiHCl_{3} + H_{2}\xlongequal{1 357\;K}Si + 3HCl}$
(2)${SiHCl_{3} + 3H_{2}O\xlongequal{\phantom{\rule[-.2em]{0ex}{0ex}}}H_{2}SiO_{3}\downarrow + 3HCl + H_{2}\uparrow }$ 高温下${H_{2}}$与${O_{2}}$反应发生爆炸
(1)${SiHCl_{3} + H_{2}\xlongequal{1 357\;K}Si + 3HCl}$
(2)${SiHCl_{3} + 3H_{2}O\xlongequal{\phantom{\rule[-.2em]{0ex}{0ex}}}H_{2}SiO_{3}\downarrow + 3HCl + H_{2}\uparrow }$ 高温下${H_{2}}$与${O_{2}}$反应发生爆炸
查看更多完整答案,请扫码查看


