2025年世纪金榜新视野暑假作业高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年世纪金榜新视野暑假作业高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
|实例|影响速率的因素|
|(1)夏天食物易变质|
|(2)硫在氧气中比在空气燃烧快|
|(3)粉末状的碳酸钙比块状的碳酸钙与盐酸反应快|
|(4)氯酸钾与二氧化锰混合共热可快速产生氧气|
|(5)工业合成氨通常要在高压下进行|
|(6)镁与盐酸的反应比铝快得多|
|(1)夏天食物易变质|
温度
||(2)硫在氧气中比在空气燃烧快|
浓度
||(3)粉末状的碳酸钙比块状的碳酸钙与盐酸反应快|
接触面积
||(4)氯酸钾与二氧化锰混合共热可快速产生氧气|
催化剂
||(5)工业合成氨通常要在高压下进行|
压强
||(6)镁与盐酸的反应比铝快得多|
金属本身性质
|
答案:
(1)温度
(2)浓度
(3)接触面积
(4)催化剂
(5)压强
(6)金属本身性质
(1)温度
(2)浓度
(3)接触面积
(4)催化剂
(5)压强
(6)金属本身性质
16. (16分)影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响。
药品:Cu、Fe、Na和不同浓度的硫酸$(0.5mol·L⁻^1、$$2mol·L⁻^1、$$18.4mol·L⁻^1);$
装置如图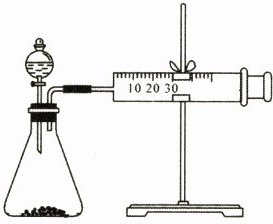
(1)用此装置进行定量实验,应选用的上述实验药品是:
第一组:
第二组:
(2)应该测定的实验数据是气体从反应开始到推动活塞达到30mL刻度时的
(3)此实验忽视了影响反应速率的其他因素是(假设金属颗粒是均匀的):
(4)此实验得到的结论应该是硫酸的浓度越
药品:Cu、Fe、Na和不同浓度的硫酸$(0.5mol·L⁻^1、$$2mol·L⁻^1、$$18.4mol·L⁻^1);$
装置如图

(1)用此装置进行定量实验,应选用的上述实验药品是:
第一组:
Fe
和0.5 mol·L⁻¹硫酸
。第二组:
Fe
和2 mol·L⁻¹硫酸
。(2)应该测定的实验数据是气体从反应开始到推动活塞达到30mL刻度时的
时间
。(3)此实验忽视了影响反应速率的其他因素是(假设金属颗粒是均匀的):
温度
。(4)此实验得到的结论应该是硫酸的浓度越
高
,反应速率越快
。(填“高”“低”“快”“慢”)
答案:
(1)Fe $ 0.5 \ mol \cdot L^{-1} $ 硫酸 Fe $ 2 \ mol \cdot L^{-1} $ 硫酸
(2)时间
(3)温度
(4)高 快(或低 慢)
(1)Fe $ 0.5 \ mol \cdot L^{-1} $ 硫酸 Fe $ 2 \ mol \cdot L^{-1} $ 硫酸
(2)时间
(3)温度
(4)高 快(或低 慢)
17. (16分)目前,汽车厂商常利用催化技术将汽车尾气中的CO和NO转化成$CO_2$和$N_2,$反应方程式为2NO+2CO⇌[催化剂$]2CO_2+N_2。$为研究如何提高该转化过程的反应速率,降低NO、CO的污染,某课题组进行了以下实验探究。
【资料查阅】①不同的催化剂对同一反应的催化效率不同;②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】该课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成下列实验设计表。
已知实验Ⅰ、Ⅱ、Ⅲ中NO和CO的初始浓度均相同,分别为$6.50×10⁻^3mol·L⁻^1、$$4.00×10⁻^3mol·L⁻^1。$
|实验编号|实验目的|T/℃|同种催化剂的比表面积$/(m^2·g⁻^1)$|
|Ⅰ|为以下实验作参照|280|80|
|Ⅱ|①
|Ⅲ|探究温度对尾气转化速率的影响|360|③
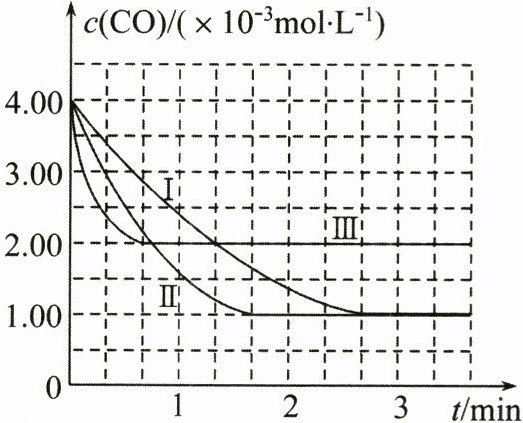
【图像分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线,如图所示。
(2)由曲线Ⅲ可知,0~2/3min内,用NO表示的反应速率为
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂的比表面积,汽车尾气转化速率
【资料查阅】①不同的催化剂对同一反应的催化效率不同;②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】该课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成下列实验设计表。
已知实验Ⅰ、Ⅱ、Ⅲ中NO和CO的初始浓度均相同,分别为$6.50×10⁻^3mol·L⁻^1、$$4.00×10⁻^3mol·L⁻^1。$
|实验编号|实验目的|T/℃|同种催化剂的比表面积$/(m^2·g⁻^1)$|
|Ⅰ|为以下实验作参照|280|80|
|Ⅱ|①
探究催化剂的比表面积对尾气转化速率的影响
|②280
|120||Ⅲ|探究温度对尾气转化速率的影响|360|③
80
|【图像分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线,如图所示。
(2)由曲线Ⅲ可知,0~2/3min内,用NO表示的反应速率为
$3.00×10^{-3}mol·L^{-1}·min^{-1}$
。(3)由曲线Ⅰ、Ⅱ可知,增大催化剂的比表面积,汽车尾气转化速率
增大
(填“增大”“减小”或“不变”)。
答案:
【解析】
(1)由表中数据可知,实验Ⅱ探究的是催化剂的比表面积对尾气转化速率的影响,所以温度应与实验Ⅰ相同,为 $ 280^{\circ}C $。实验Ⅲ探究的是温度对尾气转化速率的影响,所以同种催化剂的比表面积应与实验Ⅰ相同,为 $ 80 \ m^2 \cdot g^{-1} $。
(2)由曲线Ⅲ可知, $ \frac{2}{3} \ min $ 时, $ c(CO) $ 为 $ 2.00 × 10^{-3} \ mol \cdot L^{-1} $,初始时, $ c(CO) $ 为 $ 4.00 × 10^{-3} \ mol \cdot L^{-1} $,所以 $ \Delta c(CO) = 2.00 × 10^{-3} \ mol \cdot L^{-1} $,由于 CO 与 NO 以 $ 1:1 $ 反应,所以 $ \Delta c(NO) = 2.00 × 10^{-3} \ mol \cdot L^{-1} $,则用 NO 表示的反应速率为 $ 2.00 × 10^{-3} \ mol \cdot L^{-1} ÷ \frac{2}{3} \ min = 3.00 × 10^{-3} \ mol \cdot L^{-1} \cdot min^{-1} $。
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂的比表面积,汽车尾气转化速率增大。答案:
(1)①探究催化剂的比表面积对尾气转化速率的影响 ②280 ③80
(2) $ 3.00 × 10^{-3} \ mol \cdot L^{-1} \cdot min^{-1} $
(3)增大
(1)由表中数据可知,实验Ⅱ探究的是催化剂的比表面积对尾气转化速率的影响,所以温度应与实验Ⅰ相同,为 $ 280^{\circ}C $。实验Ⅲ探究的是温度对尾气转化速率的影响,所以同种催化剂的比表面积应与实验Ⅰ相同,为 $ 80 \ m^2 \cdot g^{-1} $。
(2)由曲线Ⅲ可知, $ \frac{2}{3} \ min $ 时, $ c(CO) $ 为 $ 2.00 × 10^{-3} \ mol \cdot L^{-1} $,初始时, $ c(CO) $ 为 $ 4.00 × 10^{-3} \ mol \cdot L^{-1} $,所以 $ \Delta c(CO) = 2.00 × 10^{-3} \ mol \cdot L^{-1} $,由于 CO 与 NO 以 $ 1:1 $ 反应,所以 $ \Delta c(NO) = 2.00 × 10^{-3} \ mol \cdot L^{-1} $,则用 NO 表示的反应速率为 $ 2.00 × 10^{-3} \ mol \cdot L^{-1} ÷ \frac{2}{3} \ min = 3.00 × 10^{-3} \ mol \cdot L^{-1} \cdot min^{-1} $。
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂的比表面积,汽车尾气转化速率增大。答案:
(1)①探究催化剂的比表面积对尾气转化速率的影响 ②280 ③80
(2) $ 3.00 × 10^{-3} \ mol \cdot L^{-1} \cdot min^{-1} $
(3)增大
查看更多完整答案,请扫码查看


