2025年世纪金榜新视野暑假作业高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年世纪金榜新视野暑假作业高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
14. 用氮化硅$(Si_3N_4)$陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:$3SiCl_4(g)+2N_2(g)+6H_2(g)⇌Si_3N_4(s)+12HCl(g)。$一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是(

A.v逆$(N_2)= 3v$正$(H_2)$
B.v正(HCl)= 4v正$(SiCl_4)$
C.混合气体密度保持不变
$D.c(N_2):c(H_2):c(HCl)= 1:3:6$
C
)
A.v逆$(N_2)= 3v$正$(H_2)$
B.v正(HCl)= 4v正$(SiCl_4)$
C.混合气体密度保持不变
$D.c(N_2):c(H_2):c(HCl)= 1:3:6$
答案:
C
15. 在一个体积固定的密闭容器中,进行的可逆反应A(s)+3B(g)⇌3C(g)。下列叙述中表明可逆反应一定达到平衡状态的是(
①C的生成速率与C的分解速率相等;②单位时间内生成a mol A,同时生成3a mol B;③B的浓度不再变化;④混合气体总的物质的量不再发生变化;⑤A、B、C的物质的量之比为1:3:3;⑥混合气体的密度不再变化。
C. $\textcircled{1}\textcircled{3}\textcircled{6}$
C
)①C的生成速率与C的分解速率相等;②单位时间内生成a mol A,同时生成3a mol B;③B的浓度不再变化;④混合气体总的物质的量不再发生变化;⑤A、B、C的物质的量之比为1:3:3;⑥混合气体的密度不再变化。
A. $\textcircled{1}\textcircled{2}\textcircled{3}$
B. $\textcircled{1}\textcircled{3}\textcircled{4}\textcircled{6}$
C. $\textcircled{1}\textcircled{3}\textcircled{6}$
D. $\textcircled{1}\textcircled{3}\textcircled{4}\textcircled{5}$
答案:
C ①C的生成速率与C的分解速率相等,说明正逆反应速率相等,故①正确;②化学反应速率之比等于化学计量数之比,无论是否达到平衡状态,都存在单位时间生成$a\ mol\ A$,同时生成$3a\ mol\ B$,故②错误;③当反应达到化学平衡状态时,各物质的浓度不变,故③正确;④气体反应物与气体生成物的化学计量数之和相等,无论是否达到平衡状态,混合气体总的物质的量都不变,故④错误;⑤平衡时各物质的物质的量取决于起始物质的量的比以及转化的程度,不能作为判断是否达到平衡状态的依据,故⑤错误;⑥A为固体,当反应达到平衡状态时,气体的总质量不变,反应达到平衡状态,故⑥正确。
16. (13分)在某化学反应中,反应混合物A、B、C的物质的量浓度$(mol·L⁻^1)$与时间t(s)的关系如表所示。
| t/s | 200 | 400 | 800 |
|$ c(A)/(mol·L⁻^1) $| 1.45 | 1.28 | 1.00 |
|$ c(B)/(mol·L⁻^1) $| 0.38 | 0.72 | 1.28 |
|$ c(C)/(mol·L⁻^1) $| 0.095 | 0.18 | 0.32 |
(1)该反应的化学方程式为
(2)用A的浓度变化表示200~800s内反应的平均反应速率为
(3)用C的浓度变化表示400~800s内反应的平均反应速率为
| t/s | 200 | 400 | 800 |
|$ c(A)/(mol·L⁻^1) $| 1.45 | 1.28 | 1.00 |
|$ c(B)/(mol·L⁻^1) $| 0.38 | 0.72 | 1.28 |
|$ c(C)/(mol·L⁻^1) $| 0.095 | 0.18 | 0.32 |
(1)该反应的化学方程式为
2A=4B+C
。(2)用A的浓度变化表示200~800s内反应的平均反应速率为
0.045
$mol·L⁻^1·min⁻^1。$(3)用C的浓度变化表示400~800s内反应的平均反应速率为
3.5×10^{-4}
$mol·L⁻^1·s⁻^1。$
答案:
(1)$2A=4B+C$
(2)0.045
(3)$3.5×10^{-4}$
(1)$2A=4B+C$
(2)0.045
(3)$3.5×10^{-4}$
17. (13分)恒温恒容下,将2mol A气体和2mol B气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g)⇌xC(g)+2D(s),2min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为$1.2mol·L⁻^1。$
(1)从开始反应至达到平衡状态,生成C的平均反应速率为______
(2)x= ______
(3)A的转化率与B的转化率之比为______
(4)下列各项可作为该反应达到平衡状态的标志的是______
A. 压强不再变化
B. 气体密度不再变化
C. 气体的平均相对分子质量不再变化
D. A的消耗速率与B的消耗速率之比为2:1
(1)从开始反应至达到平衡状态,生成C的平均反应速率为______
$0.6\ mol\cdot L^{-1}\cdot min^{-1}$
。(2)x= ______
3
。(3)A的转化率与B的转化率之比为______
$2:1$
。(4)下列各项可作为该反应达到平衡状态的标志的是______
B、C
。A. 压强不再变化
B. 气体密度不再变化
C. 气体的平均相对分子质量不再变化
D. A的消耗速率与B的消耗速率之比为2:1
答案:
(1)$0.6\ mol\cdot L^{-1}\cdot min^{-1}$
(2)3
(3)$2:1$
(4)B、C
(1)$0.6\ mol\cdot L^{-1}\cdot min^{-1}$
(2)3
(3)$2:1$
(4)B、C
18. (14分)在2L密闭容器内,800℃时反应$2NO(g)+O_2(g)⇌2NO_2(g)$体系中,n(NO)随时间的变化如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应
(2)如图中表示$NO_2$变化曲线的是
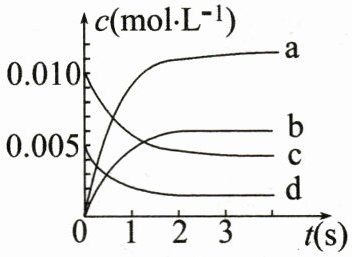
(3)能说明该反应已达到平衡状态的是
$a. v(NO_2)= 2v(O_2)$
b. 容器内压强保持不变
c. v逆(NO)= 2v正$(O_2)$
d. 容器内密度保持不变
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应
是
(填“是”或“不是”)可逆反应,在第5s时,NO的转化率为65%
。(2)如图中表示$NO_2$变化曲线的是
b
。用$O_2$表示0~2s内该反应的平均速率v=$1.5×10^{-3}\ mol\cdot L^{-1}\cdot s^{-1}$
。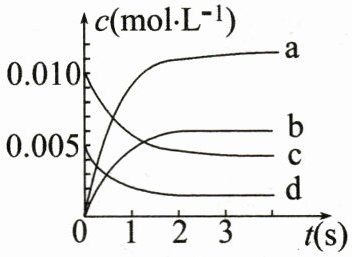
(3)能说明该反应已达到平衡状态的是
b、c
。$a. v(NO_2)= 2v(O_2)$
b. 容器内压强保持不变
c. v逆(NO)= 2v正$(O_2)$
d. 容器内密度保持不变
答案:
(1)是 65%
(2)b $1.5×10^{-3}\ mol\cdot L^{-1}\cdot s^{-1}$
(3)b、c
(1)是 65%
(2)b $1.5×10^{-3}\ mol\cdot L^{-1}\cdot s^{-1}$
(3)b、c
查看更多完整答案,请扫码查看


