2025年世纪金榜新视野暑假作业高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年世纪金榜新视野暑假作业高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
14. 根据下面的信息,判断下列叙述正确的是(
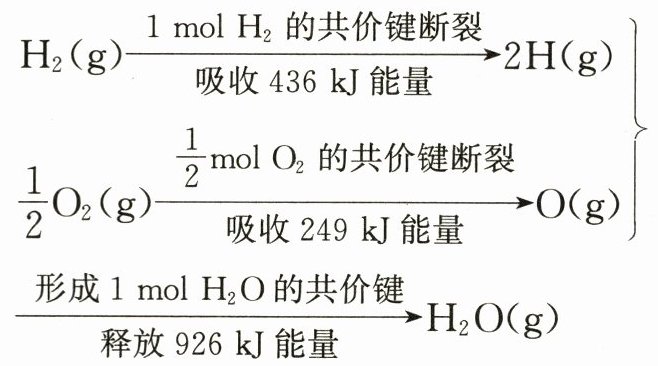
A.氢气跟氧气反应生成水的同时释放能量
B.氢气跟氧气反应生成水的同时吸收能量
C.$1\ {mol H_{2}}跟\dfrac{1}{2}\ {mol O_{2}}反应生成1\ {mol H_{2}O}一定释放能量241\ {kJ}$
D.$2\ {mol H_{2}(g)}跟1\ {mol O_{2}(g)}反应生成2\ {mol H_{2}O(g)}吸收能量482\ {kJ}$
A
)
A.氢气跟氧气反应生成水的同时释放能量
B.氢气跟氧气反应生成水的同时吸收能量
C.$1\ {mol H_{2}}跟\dfrac{1}{2}\ {mol O_{2}}反应生成1\ {mol H_{2}O}一定释放能量241\ {kJ}$
D.$2\ {mol H_{2}(g)}跟1\ {mol O_{2}(g)}反应生成2\ {mol H_{2}O(g)}吸收能量482\ {kJ}$
答案:
A 由题中信息可知,1 mol H₂(g)的共价键断裂吸收能量436 kJ,$\frac{1}{2}$ mol O₂(g)的共价键断裂吸收能量249 kJ,两项共吸收能量685 kJ;形成2 mol H—O键时共释放能量926 kJ。
在1 mol H₂(g)和$\frac{1}{2}$ mol O₂(g)反应生成1 mol H₂O(g)的过程中,释放的能量比吸收的能量多241 kJ,C项中缺少物质的状态,所以释放的能量不一定是241 kJ。
在1 mol H₂(g)和$\frac{1}{2}$ mol O₂(g)反应生成1 mol H₂O(g)的过程中,释放的能量比吸收的能量多241 kJ,C项中缺少物质的状态,所以释放的能量不一定是241 kJ。
15. (14分)实验测得$1\ {mol H_{2}}与1\ {mol Cl_{2}}反应生成2\ {mol HCl}$时,放出$184.6\ {kJ}$的热量,其理论分析数据与实验数据略有差异,如图所示为上述反应能量变化的理论分析示意图。

(1)化学键断裂需要
(2)图中共释放能量
(3)该反应的反应物的总能量
(4)用图示数据计算其反应热$\Delta H= $

(1)化学键断裂需要
吸收
(填“释放”或“吸收”)能量。(2)图中共释放能量
862
${kJ}$。(3)该反应的反应物的总能量
大于
(填“大于”“等于”或“小于”)反应产物的能量,所以该反应是放热
(填“吸热”或“放热”)反应。(4)用图示数据计算其反应热$\Delta H= $
$-183 kJ·mol^{-1}$
。
答案:
(1)吸收
(2)862
(3)大于 放热
(4)$-183 kJ·mol^{-1}$
(1)吸收
(2)862
(3)大于 放热
(4)$-183 kJ·mol^{-1}$
16. (15分)我国自主研发的空间燃料电池首次在轨试验成功完成,推动了宇航燃料电池的应用发展。如图为氢氧燃料电池的结构示意图,电解质溶液为${KOH}$溶液,电极材料为疏松多孔石墨棒。当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流。

试回答下列问题:
(1)燃料电池的优点是
(2)写出氢氧燃料电池工作时正极反应式:

试回答下列问题:
(1)燃料电池的优点是
能量利用率高,绿色无污染
;电解质溶液中的${OH^{-}}$移向负
(填“负”或“正”)极。(2)写出氢氧燃料电池工作时正极反应式:
$2H_{2}O + O_{2} + 4e^{-} = 4OH^{-}$
。
答案:
(1)能量利用率高,绿色无污染 负
(2)$2H_{2}O + O_{2} + 4e^{-} = 4OH^{-}$
(1)能量利用率高,绿色无污染 负
(2)$2H_{2}O + O_{2} + 4e^{-} = 4OH^{-}$
17. (15分)依据氧化还原反应:${2Ag^{+}(aq) + Cu(s)\xlongequal{}Cu^{2+}(aq) + 2Ag(s)}$设计的原电池如图所示。请回答下列问题:

(1)电极${X}$的材料是
(2)银电极为电池的
(3)外电路中的电子是从
(4)当有$1.6\ {g}$铜溶解时,银棒增重

(1)电极${X}$的材料是
Cu
;电解质溶液${Y}$是AgNO₃
。(2)银电极为电池的
正
极,电极反应式为$Ag^{+} + e^{-} = Ag$
;${X}$电极上发生的电极反应为氧化反应
(填反应类型)。(3)外电路中的电子是从
X(或Cu)
电极流向Ag
电极。(4)当有$1.6\ {g}$铜溶解时,银棒增重
5.4 g
。
答案:
(1)Cu AgNO₃
(2)正 $Ag^{+} + e^{-} = Ag$ 氧化反应
(3)X(或Cu) Ag
(4)5.4 g
(1)Cu AgNO₃
(2)正 $Ag^{+} + e^{-} = Ag$ 氧化反应
(3)X(或Cu) Ag
(4)5.4 g
查看更多完整答案,请扫码查看


