2025年玩转全课程八年级科学全一册浙教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年玩转全课程八年级科学全一册浙教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第59页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
10. 硫铁矿厂开采的黄铁矿(主要成分是$FeS_{2}$),是生产$H_{2}SO_{4}$的重要原料。利用黄铁矿生产$H_{2}SO_{4}$的第一步反应为:$4FeS_{2}+11O_{2}= 2Fe_{2}O_{3}+8X$,所得产物$Fe_{2}O_{3}$是冶炼铁的重要原料。据此回答下列问题:
(1)已知$FeS_{2}$中Fe的化合价为+2,则S的化合价为
(2)X的化学式是
(3)已知工业上炼铁用一氧化碳和氧化铁在高温下反应生成铁和二氧化碳,请写出相关化学方程式:
(1)已知$FeS_{2}$中Fe的化合价为+2,则S的化合价为
-1
。(2)X的化学式是
${SO_{2}}$
。(3)已知工业上炼铁用一氧化碳和氧化铁在高温下反应生成铁和二氧化碳,请写出相关化学方程式:
${3CO + Fe_{2}O_{3}\xlongequal{高温}2Fe + 3CO_{2}}$
。
答案:
(1)-1
(2)${SO_{2}}$
(3)${3CO + Fe_{2}O_{3}\xlongequal{高温}2Fe + 3CO_{2}}$
(1)-1
(2)${SO_{2}}$
(3)${3CO + Fe_{2}O_{3}\xlongequal{高温}2Fe + 3CO_{2}}$
11. 化学反应的实质是构成物质分子的原子重新进行组合,形成新分子的过程。下图是在密闭容器中某化学反应过程的微观示意图。据图回答。
(1)参加反应的“ ”与“
”与“ ”的分子个数比为____
”的分子个数比为____
(2)该反应的基本反应类型是____
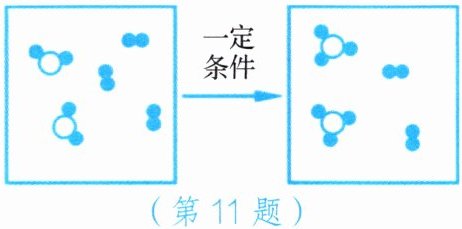
(1)参加反应的“
 ”与“
”与“ ”的分子个数比为____
”的分子个数比为____2:1
____。(2)该反应的基本反应类型是____
化合反应
____。
答案:
2:1 化合反应
12. 某老师在实验室制取二氧化碳,他先称量稀盐酸及烧杯的总质量为100g,然后加入10g大理石,充分反应后称得总质量为107.8g。求:
(1)生成的二氧化碳的质量。
(2)大理石中碳酸钙的质量分数。
(1)生成的二氧化碳的质量。
(2)大理石中碳酸钙的质量分数。
答案:
$(1)$ 计算生成二氧化碳的质量
根据质量守恒定律,反应前后物质的总质量差即为生成二氧化碳的质量。
解:
反应前总质量$m_1 = 100g + 10g=110g$,反应后总质量$m_2 = 107.8g$。
生成二氧化碳的质量$m(CO_2)=m_1 - m_2=110g - 107.8g = 2.2g$。
$(2)$ 计算大理石中碳酸钙的质量分数
设大理石中碳酸钙的质量为$x$。
碳酸钙与稀盐酸反应的化学方程式为${CaCO_{3} + 2HCl\xlongequal{}CaCl_{2} + H_{2}O + CO_{2}\uparrow}$。
由化学方程式可知,${CaCO_{3}}$与${CO_{2}}$的质量关系为$\frac{m({CaCO_{3}})}{m({CO_{2}})}=\frac{100}{44}$($100$为${CaCO_{3}}$的相对分子质量,$44$为${CO_{2}}$的相对分子质量 )。
已知$m({CO_{2}})=2.2g$,则$\frac{x}{2.2g}=\frac{100}{44}$,
解得$x = \frac{100×2.2g}{44}=5g$。
大理石中碳酸钙的质量分数$\omega({CaCO_{3}})=\frac{5g}{10g}×100\% = 50\%$。
综上,$(1)$ 生成二氧化碳的质量为$\boldsymbol{2.2g}$;$(2)$ 大理石中碳酸钙的质量分数为$\boldsymbol{50\%}$。
根据质量守恒定律,反应前后物质的总质量差即为生成二氧化碳的质量。
解:
反应前总质量$m_1 = 100g + 10g=110g$,反应后总质量$m_2 = 107.8g$。
生成二氧化碳的质量$m(CO_2)=m_1 - m_2=110g - 107.8g = 2.2g$。
$(2)$ 计算大理石中碳酸钙的质量分数
设大理石中碳酸钙的质量为$x$。
碳酸钙与稀盐酸反应的化学方程式为${CaCO_{3} + 2HCl\xlongequal{}CaCl_{2} + H_{2}O + CO_{2}\uparrow}$。
由化学方程式可知,${CaCO_{3}}$与${CO_{2}}$的质量关系为$\frac{m({CaCO_{3}})}{m({CO_{2}})}=\frac{100}{44}$($100$为${CaCO_{3}}$的相对分子质量,$44$为${CO_{2}}$的相对分子质量 )。
已知$m({CO_{2}})=2.2g$,则$\frac{x}{2.2g}=\frac{100}{44}$,
解得$x = \frac{100×2.2g}{44}=5g$。
大理石中碳酸钙的质量分数$\omega({CaCO_{3}})=\frac{5g}{10g}×100\% = 50\%$。
综上,$(1)$ 生成二氧化碳的质量为$\boldsymbol{2.2g}$;$(2)$ 大理石中碳酸钙的质量分数为$\boldsymbol{50\%}$。
查看更多完整答案,请扫码查看


