3. 老师在“酸和碱的中和反应”课堂中演示了酸碱中和反应的实验,但对实验进行了改进,并对两个问题进行了讨论。
【实验操作】用胶头滴管取少量久置的NaOH溶液滴入试管中,并滴入几滴紫甘蓝汁液,然后逐滴加入稀盐酸。
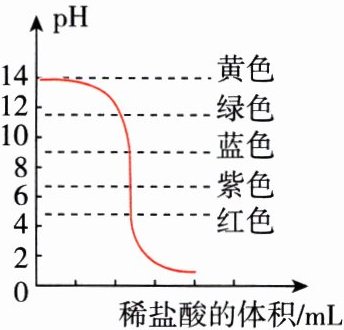
【实验现象】溶液中冒气泡,且溶液从下至上依次呈现黄色、绿色、蓝色、紫色、粉红色、深红色等,宛若彩虹、非常美丽。
【提出问题Ⅰ】为什么反应过程中溶液中呈现多彩的颜色?
【小组讨论】
男生组:反应过程中,溶液中各部位紫甘蓝汁液的浓度不同。
女生组:反应过程中,溶液中各部位的酸碱度(pH)不同。
【查阅资料】中性溶液中紫甘蓝汁为紫色。
【实验验证】老师在一个小烧杯中加入适量新配制的NaOH溶液,然后逐滴加入稀盐酸;及时观察溶液颜色的变化,同时用传感器测出反应过程中溶液pH的变化,绘制溶液pH及颜色的变化图。
【实验结论】(1)读图可知________组的讨论是正确的。
【拓展延伸】
(2)作为酸碱指示剂,紫甘蓝汁液与石蕊溶液相比,优点明显,它既能测出溶液的酸碱性,还能显示溶液的________________。
(3)当酸碱恰好完全中和时,溶液呈_______色;当溶液呈绿色时,对应溶液中的溶质为____________。
【提出问题Ⅱ】久置的NaOH溶液的溶质成分是否变质?
【小组讨论】
男生组:该溶液没有变质;
女生组:该溶液全部变质。
(4)我的观点:该溶液________________。
【观点分析】(5)依据老师的实验操作观察到的实验现象可确定________组的观点是不正确的。
【查阅资料】BaCl₂溶液显中性;BaCl₂ + Na₂CO₃ = BaCO₃↓ + 2NaCl。
【我的实验】(6)取少量久置的NaOH溶液,滴入____________________,产生白色沉淀;再向上层清液中滴入几滴紫甘蓝汁液,溶液显黄色。因此,这瓶久置的NaOH溶液的溶质成分是________________。
【评价反思】(7)取少量久置的NaOH溶液于试管中,逐滴加入足量稀盐酸,_______(填“立即”或“稍后”)有大量的气泡产生,也可以得出与我相同的结论。
【实验操作】用胶头滴管取少量久置的NaOH溶液滴入试管中,并滴入几滴紫甘蓝汁液,然后逐滴加入稀盐酸。
【实验现象】溶液中冒气泡,且溶液从下至上依次呈现黄色、绿色、蓝色、紫色、粉红色、深红色等,宛若彩虹、非常美丽。
【提出问题Ⅰ】为什么反应过程中溶液中呈现多彩的颜色?
【小组讨论】
男生组:反应过程中,溶液中各部位紫甘蓝汁液的浓度不同。
女生组:反应过程中,溶液中各部位的酸碱度(pH)不同。
【查阅资料】中性溶液中紫甘蓝汁为紫色。
【实验验证】老师在一个小烧杯中加入适量新配制的NaOH溶液,然后逐滴加入稀盐酸;及时观察溶液颜色的变化,同时用传感器测出反应过程中溶液pH的变化,绘制溶液pH及颜色的变化图。
【实验结论】(1)读图可知________组的讨论是正确的。
【拓展延伸】
(2)作为酸碱指示剂,紫甘蓝汁液与石蕊溶液相比,优点明显,它既能测出溶液的酸碱性,还能显示溶液的________________。
(3)当酸碱恰好完全中和时,溶液呈_______色;当溶液呈绿色时,对应溶液中的溶质为____________。
【提出问题Ⅱ】久置的NaOH溶液的溶质成分是否变质?
【小组讨论】
男生组:该溶液没有变质;
女生组:该溶液全部变质。
(4)我的观点:该溶液________________。
【观点分析】(5)依据老师的实验操作观察到的实验现象可确定________组的观点是不正确的。
【查阅资料】BaCl₂溶液显中性;BaCl₂ + Na₂CO₃ = BaCO₃↓ + 2NaCl。
【我的实验】(6)取少量久置的NaOH溶液,滴入____________________,产生白色沉淀;再向上层清液中滴入几滴紫甘蓝汁液,溶液显黄色。因此,这瓶久置的NaOH溶液的溶质成分是________________。
【评价反思】(7)取少量久置的NaOH溶液于试管中,逐滴加入足量稀盐酸,_______(填“立即”或“稍后”)有大量的气泡产生,也可以得出与我相同的结论。

答案:
女生@@酸碱性强弱@@紫@@氯化钠、氢氧化钠@@部分变质@@男生@@过量氯化钡溶液@@氢氧化钠、碳酸钠@@稍后
查看更多完整答案,请扫码查看


