8. [2022徐州模拟]“粗盐的初步提纯”是初中化学教科书中的基础实验。下列关于该实验的叙述错误的是 ( )
A. 实验操作步骤是称量、溶解、过滤、蒸发
B. 在溶解操作中,需要使用的仪器有烧杯、玻璃棒
C. 经过两次过滤,滤液仍浑浊,应检查过滤装置等,找出原因
D. 在蒸发溶剂的操作中,必须蒸干蒸发皿中的水分才能停止加热
A. 实验操作步骤是称量、溶解、过滤、蒸发
B. 在溶解操作中,需要使用的仪器有烧杯、玻璃棒
C. 经过两次过滤,滤液仍浑浊,应检查过滤装置等,找出原因
D. 在蒸发溶剂的操作中,必须蒸干蒸发皿中的水分才能停止加热
答案:
D
9. [2024无锡一模]如图为NH<sub>4</sub>Cl、NaCl的溶解度曲线,下列有关说法正确的是 ( )
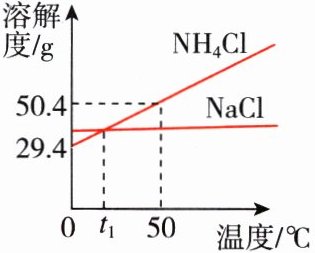
A. NaCl的溶解度一定小于NH<sub>4</sub>Cl的溶解度
B. t<sub>1</sub>℃时,NaCl、NH<sub>4</sub>Cl的饱和溶液中溶质的质量相等
C. 除去NH<sub>4</sub>Cl中的NaCl,可用蒸发结晶的方法
D. 将100 g 50℃时NH<sub>4</sub>Cl饱和溶液冷却至0℃,析出晶体的质量小于21 g

A. NaCl的溶解度一定小于NH<sub>4</sub>Cl的溶解度
B. t<sub>1</sub>℃时,NaCl、NH<sub>4</sub>Cl的饱和溶液中溶质的质量相等
C. 除去NH<sub>4</sub>Cl中的NaCl,可用蒸发结晶的方法
D. 将100 g 50℃时NH<sub>4</sub>Cl饱和溶液冷却至0℃,析出晶体的质量小于21 g
答案:
D 点拨:比较不同物质的溶解度大小必须说明具体温度,否则不能比较溶解度大小,故A错误;t₁℃时,虽然NaCl、NH₄Cl的溶解度相等,但NaCl、NH₄Cl的饱和溶液的质量不能确定,所以饱和溶液中溶质的质量不能确定,故B错误;NH₄Cl的溶解度受温度变化影响较大,所以除去NH₄Cl中的NaCl,可用降温结晶的方法得到NH₄Cl固体,故C错误;50℃时NH₄Cl的溶解度是50.4g,0℃时NH₄Cl的溶解度是29.4g,则将150.4g 50℃的NH₄Cl饱和溶液冷却至0℃,析出晶体的质量为50.4g - 29.4g = 21g,如果将100g 50℃时NH₄Cl饱和溶液冷却至0℃,析出晶体的质量小于21g,故D正确。
10. [2023西安一模]下表是氯化钠和氯化钾在不同温度时的溶解度。
|温度/℃|0|20|40|60|80|
|----|----|----|----|----|----|
|溶解度/g|NaCl|35.7|35.9|36.4|37.1|38.4|
|KCl|27.6|34.0|40.0|45.5|51.1|
(1)40℃时,氯化钠的溶解度为_______。
(2)20℃时,将20 g氯化钠固体加入50 g水中,充分溶解,所得氯化钠溶液为_______(填“饱和溶液”或“不饱和溶液”)。
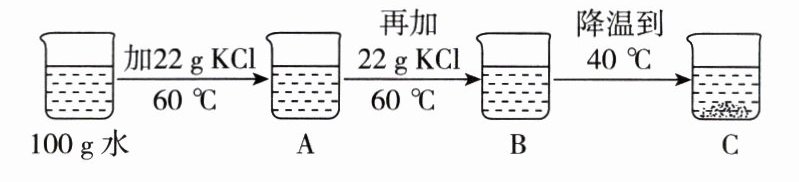
(3)某同学进行如图所示实验,得到相应的A、B、C三种溶液,C中析出氯化钾固体的质量为_______g。为使C中固体全部溶解,至少需加入_______g水。
|温度/℃|0|20|40|60|80|
|----|----|----|----|----|----|
|溶解度/g|NaCl|35.7|35.9|36.4|37.1|38.4|
|KCl|27.6|34.0|40.0|45.5|51.1|
(1)40℃时,氯化钠的溶解度为_______。
(2)20℃时,将20 g氯化钠固体加入50 g水中,充分溶解,所得氯化钠溶液为_______(填“饱和溶液”或“不饱和溶液”)。
(3)某同学进行如图所示实验,得到相应的A、B、C三种溶液,C中析出氯化钾固体的质量为_______g。为使C中固体全部溶解,至少需加入_______g水。

答案:
36.4g@@饱和溶液@@4@@10@@点拨:(2)20℃时,氯化钠的溶解度为35.9g,则该温度下,50g水中最多可溶解17.95g氯化钠固体,则将20g氯化钠固体加入50g水中,得到的是饱和溶液。(3)40℃时,氯化钾的溶解度为40.0g,则该温度下,100g水中最多可溶解40.0g氯化钾固体,一共加入氯化钾固体的质量为44g,则还有4g固体未溶解;若想使C中固体完全溶解,至少需加入水的质量为4g×$\frac{100g}{40g}$ = 10g。
11. 真实情境题 枇杷秋梨膏有润肺、止咳、生津的功效,其熬制过程涉及清洗原料、把梨切块、武火熬汁、纱布滤渣、文火熬膏等过程。下列与蒸发结晶过程相似的是 ( )
A. 清洗原料
B. 把梨切块
C. 纱布滤渣
D. 文火熬膏
A. 清洗原料
B. 把梨切块
C. 纱布滤渣
D. 文火熬膏
答案:
D
12. [2024常州模拟] “溶解”是化学学科的核心概念之一。某兴趣小组的同学对固体物质的溶解展开探究。
Ⅰ. 溶解过程探究
按图1所示进行实验。闭合开关,观察到小灯泡不亮。再将10 g氯化钠放入水中,观察现象。
(1)固体溶解过程中小灯泡_______(填“变亮”或“不亮”),说明氯化钠在溶解过程中是以_______的形式分散到水中。
(2)将氯化钠改成蔗糖重复实验,可观察到实验现象与氯化钠溶解_______(填“相同”或“不同”)。

Ⅱ. 溶解性影响因素探究
【初步探究】按图2所示进行实验。
(3)实验中振荡的目的是_______。
(4)B中观察到固体不再减少,此时溶液为_______(填“饱和”或“不饱和”)状态。
(5)根据图2实验可得出结论:物质的溶解性与_______有关。
【深入思考】同学们讨论后认为通过加热或增加溶剂的量也能使B中固体溶解,物质的溶解性可能与这两个因素有关。
【查阅资料】硫酸铜溶液能吸收红、黄光而使溶液呈现蓝色。当一束平行单色光照射硫酸铜溶液时,溶液浓度越大,对于红、黄光的吸收能力越强,透过溶液的光强度越小。
【实验探究】
①取试管a加入2药匙硫酸铜晶体和10 mL饱和CuSO<sub>4</sub>溶液;另取试管b重复上述操作。
②将试管a、b分别装入光强度采集装置(图3为装置原理图)。
③加热试管a并持续测量透过溶液的光线的光强度,复制数据导入软件中绘制出“光强度—时间”曲线,如图4所示。
④在试管b内加入3 mL水并持续测量透过溶液的光线的光强度,复制数据导入软件中绘制“光强度—时间”曲线,如图5所示。

(6)由图4可知,温度越高,硫酸铜的溶解性越_______(填“强”或“弱”)。
(7)图5中,一开始光强度数值增大的原因是_______。
(8)依据图5,请写出硫酸铜的溶解性与溶剂水质量的关系及判断依据:_______。
Ⅰ. 溶解过程探究
按图1所示进行实验。闭合开关,观察到小灯泡不亮。再将10 g氯化钠放入水中,观察现象。
(1)固体溶解过程中小灯泡_______(填“变亮”或“不亮”),说明氯化钠在溶解过程中是以_______的形式分散到水中。
(2)将氯化钠改成蔗糖重复实验,可观察到实验现象与氯化钠溶解_______(填“相同”或“不同”)。

Ⅱ. 溶解性影响因素探究
【初步探究】按图2所示进行实验。
(3)实验中振荡的目的是_______。
(4)B中观察到固体不再减少,此时溶液为_______(填“饱和”或“不饱和”)状态。
(5)根据图2实验可得出结论:物质的溶解性与_______有关。
【深入思考】同学们讨论后认为通过加热或增加溶剂的量也能使B中固体溶解,物质的溶解性可能与这两个因素有关。
【查阅资料】硫酸铜溶液能吸收红、黄光而使溶液呈现蓝色。当一束平行单色光照射硫酸铜溶液时,溶液浓度越大,对于红、黄光的吸收能力越强,透过溶液的光强度越小。
【实验探究】
①取试管a加入2药匙硫酸铜晶体和10 mL饱和CuSO<sub>4</sub>溶液;另取试管b重复上述操作。
②将试管a、b分别装入光强度采集装置(图3为装置原理图)。
③加热试管a并持续测量透过溶液的光线的光强度,复制数据导入软件中绘制出“光强度—时间”曲线,如图4所示。
④在试管b内加入3 mL水并持续测量透过溶液的光线的光强度,复制数据导入软件中绘制“光强度—时间”曲线,如图5所示。

(6)由图4可知,温度越高,硫酸铜的溶解性越_______(填“强”或“弱”)。
(7)图5中,一开始光强度数值增大的原因是_______。
(8)依据图5,请写出硫酸铜的溶解性与溶剂水质量的关系及判断依据:_______。
答案:
变亮@@离子@@不同@@加快物质溶解@@饱和@@溶剂的种类@@强@@加水使硫酸铜溶液的浓度变小@@硫酸铜的溶解性不受水质量的影响,因为加水后最终光强度和起始值相同
查看更多完整答案,请扫码查看


