第58页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
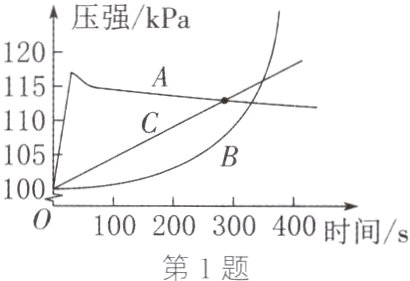
1. 小明同学取表面积相同的镁、铝、锌三种金属片,分别放入盛有质量和质量分数都相等的稀盐酸的锥形瓶中,密封装置,采集数据,得到如图所示的压强变化曲线。下列说法正确的是 ( )
A. 曲线A对应金属锌与稀盐酸反应
B. 曲线A一段时间后呈下降趋势,说明装置漏气
C. 反应后锥形瓶内的气体可直接点燃
D. 曲线B前200 s压强变化不明显,是因为铝表面有一层致密的氧化铝薄膜
A. 曲线A对应金属锌与稀盐酸反应
B. 曲线A一段时间后呈下降趋势,说明装置漏气
C. 反应后锥形瓶内的气体可直接点燃
D. 曲线B前200 s压强变化不明显,是因为铝表面有一层致密的氧化铝薄膜

答案:
D 解析:镁、铝、锌三种金属中镁的金属活动性最强,与酸反应速率最快,所以金属镁对应的压强变化曲线是A,A不正确;A曲线是金属镁与稀盐酸的反应,该反应放出大量的热,则曲线A一段时间后呈下降趋势,是热量散失导致压强减小,B不正确;镁、铝、锌与稀盐酸反应产生氢气,反应后锥形瓶中的气体是氢气,氢气不纯点燃后可能发生爆炸,需要验纯后再点燃,C不正确;铝的表面有一层致密的氧化铝薄膜,氧化铝先与稀盐酸反应生成氯化铝和水,待氧化铝反应完,铝再与稀盐酸反应生成氯化铝和氢气,所以铝对应的曲线是B,D正确。故本题选D。
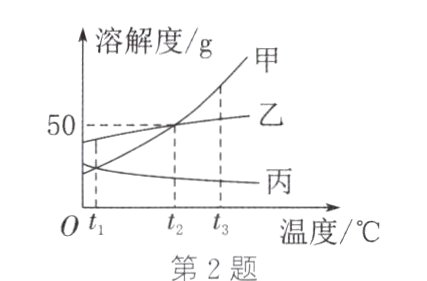
2. (2024·天津模拟)甲、乙、丙三种固体物质的溶解度曲线如图。下列说法一定正确的是 ( )
A. $t_{3}$℃时,等质量的甲、乙、丙的溶液降温到$t_{1}$℃,析出晶体最多的是甲的溶液
B. $t_{2}$℃时,将25 g乙加入50 g水中,再降温到$t_{1}$℃,所得溶液的溶质质量分数约为33.3%
C. $t_{1}$℃时,将等质量的甲、乙、丙分别溶于水,配成饱和溶液,所需水的质量大小关系为乙<甲=丙
D. $t_{1}$℃时,甲、乙、丙的饱和溶液中,所含溶质的质量大小关系为乙>甲=丙
A. $t_{3}$℃时,等质量的甲、乙、丙的溶液降温到$t_{1}$℃,析出晶体最多的是甲的溶液
B. $t_{2}$℃时,将25 g乙加入50 g水中,再降温到$t_{1}$℃,所得溶液的溶质质量分数约为33.3%
C. $t_{1}$℃时,将等质量的甲、乙、丙分别溶于水,配成饱和溶液,所需水的质量大小关系为乙<甲=丙
D. $t_{1}$℃时,甲、乙、丙的饱和溶液中,所含溶质的质量大小关系为乙>甲=丙

答案:
C 解析:由于选项说法没有指明溶液是否饱和,所以t₃℃时,等质量的甲、乙、丙的溶液降温到t₁℃时,析出晶体最多的不一定是甲的溶液,A错误。t₂℃时,乙的溶解度为50g,则t₂℃时,将25g乙加入50g水中,恰好形成饱和溶液,所得溶液的溶质质量分数为$\frac{25g}{25g + 50g}\times100\%\approx33.3\%$;再降温到t₁℃,有晶体析出,所得溶液的溶质质量分数小于33.3%,B错误。t₁℃时,甲、乙、丙三种物质的溶解度大小为乙>甲=丙,t₁℃时,将等质量的甲、乙、丙分别溶于水,配成饱和溶液,所需水的质量大小关系为乙<甲=丙,C正确。由于选项说法没有指明饱和溶液的质量大小,所以t₁℃时,无法比较甲、乙、丙三种物质的饱和溶液中所含溶质的质量大小关系,D错误。故本题选C。
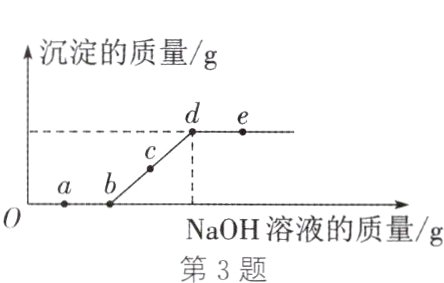
3. (2024·宿迁模拟)向某盐酸和氯化铜的混合溶液加入某浓度的氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法正确的是 ( )
A. a点溶液中含有两种溶质
B. bc段发生了中和反应
C. c点溶液中主要存在的阳离子为$Na^{+}$、$Cu^{2+}$
D. 溶液中NaCl的质量分数:d<e
A. a点溶液中含有两种溶质
B. bc段发生了中和反应
C. c点溶液中主要存在的阳离子为$Na^{+}$、$Cu^{2+}$
D. 溶液中NaCl的质量分数:d<e

答案:
C 解析:向盐酸和氯化铜的混合溶液中加入氢氧化钠溶液,氢氧化钠先与盐酸反应生成氯化钠和水,待盐酸反应完全后,氢氧化钠再与氯化铜反应生成氢氧化铜沉淀和氯化钠。a点表示的是氢氧化钠和盐酸反应,此时溶液中有生成的氯化钠、剩余的氯化氢和未反应的氯化铜三种溶质,A错误;bc段是氢氧化钠和氯化铜反应,是碱和盐发生的复分解反应,不是中和反应,B错误;c点表示在氢氧化钠和氯化铜反应过程中,溶液中有生成的氯化钠,还有剩余的氯化铜,含有的阳离子是钠离子和铜离子,C正确;d点和e点反应均已完成,溶液中含有的氯化钠的质量相等,但e点因加入了氢氧化钠溶液,使得溶液的质量更大,所以氯化钠的质量分数更小,D错误。故本题选C。
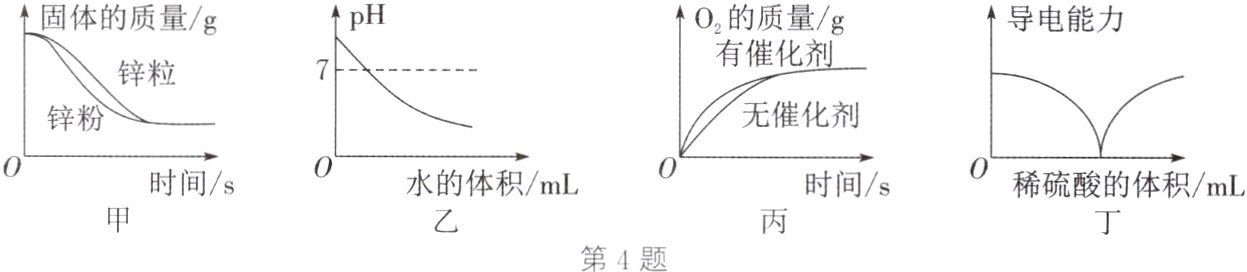
4. (2024·盐城三模)下列选项与图示中所反映的变化关系不对应的是 ( )
A. 图甲:等质量且过量的锌粉、锌粒分别与等质量、等浓度的稀盐酸反应
B. 图乙:向一定量NaOH溶液中加水稀释
C. 图丙:在相同温度下,等质量、等浓度的$H_{2}O_{2}$溶液分解制$O_{2}$
D. 图丁:向一定体积的$Ba(OH)_{2}$溶液中,逐滴滴入一定浓度的稀硫酸
A. 图甲:等质量且过量的锌粉、锌粒分别与等质量、等浓度的稀盐酸反应
B. 图乙:向一定量NaOH溶液中加水稀释
C. 图丙:在相同温度下,等质量、等浓度的$H_{2}O_{2}$溶液分解制$O_{2}$
D. 图丁:向一定体积的$Ba(OH)_{2}$溶液中,逐滴滴入一定浓度的稀硫酸

答案:
B 解析:等质量且过量的锌粉、锌粒分别与等质量、等浓度的稀盐酸反应,稀盐酸完全反应,金属有剩余,由于消耗的锌的质量相等,因此最终剩余的锌的质量也相等;反应物的接触面积越大,反应越剧烈,锌粉与稀盐酸反应的速率快,至完全反应所需时间短,A正确。氢氧化钠溶液显碱性,溶液的pH大于7,向一定量NaOH溶液中加水稀释,溶液的碱性变弱,pH逐渐减小,但溶液始终显碱性,pH不可能小于或等于7,B错误。在相同温度下,等质量、等浓度的H₂O₂溶液分解制O₂,催化剂只能影响反应速率,不影响产生氧气的质量,有催化剂的反应速率快,至完全反应所需时间短,C正确。向一定体积的Ba(OH)₂溶液中,逐滴滴入一定浓度的稀硫酸,氢氧化钡与硫酸反应生成硫酸钡沉淀和水,随着反应的进行,溶液中能自由移动的粒子减少,导电能力减弱,至恰好完全反应,溶液的导电能力减小至0;继续滴入稀硫酸,溶液的导电能力又逐渐增强,D正确。故本题选B。
5. (2023·郴州)下列各图的变化趋势与选项要求不相符的是 ( )
A. 图甲:向NaOH溶液中不断加入稀盐酸
B. 图乙:向足量的稀硫酸中,分别加入等质量的Zn、Fe
C. 图丙:T℃时,向$NH_{4}Cl$饱和溶液中加水稀释
D. 图丁:向$AgNO_{3}$溶液中加入NaCl溶液

A. 图甲:向NaOH溶液中不断加入稀盐酸
B. 图乙:向足量的稀硫酸中,分别加入等质量的Zn、Fe
C. 图丙:T℃时,向$NH_{4}Cl$饱和溶液中加水稀释
D. 图丁:向$AgNO_{3}$溶液中加入NaCl溶液

答案:
C 解析:NaOH溶液显碱性,pH>7,向NaOH溶液中不断加入稀盐酸,随着稀盐酸的加入,稀盐酸与氢氧化钠反应生成氯化钠和水,氢氧化钠被不断消耗,溶液的pH逐渐减小,直至氢氧化钠与稀盐酸恰好完全反应,溶液显中性,pH=7,然后继续加入稀盐酸,稀盐酸显酸性,pH变为小于7,A不相符。锌比铁活泼,所以向足量的稀硫酸中分别加入等质量的Zn、Fe,锌的反应速率快,完全反应所需时间短;锌与稀硫酸反应生成硫酸锌和氢气,反应的化学方程式为$Zn + H_{2}SO_{4}=ZnSO_{4}+H_{2}\uparrow$,每65份质量的锌能置换出2份质量的氢气;铁与稀硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为$Fe + H_{2}SO_{4}=FeSO_{4}+H_{2}\uparrow$,每56份质量的铁能置换出2份质量的氢气,故等质量的锌和铁与足量的稀硫酸反应,最终铁生成的氢气质量大于锌生成的氢气质量,B不相符。固体物质的溶解度只与温度有关,所以T℃时,向NH₄Cl饱和溶液中加水稀释,氯化铵的溶解度不变,C相符。向AgNO₃溶液中加入NaCl溶液,硝酸银与氯化钠反应生成氯化银沉淀和硝酸钠,随着氯化钠溶液的加入,沉淀的质量从0开始逐渐增大,直至硝酸银反应完全,沉淀的质量不再变化,D不相符。故本题选C。
查看更多完整答案,请扫码查看


