第12页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
1. 下列物质能和盐酸发生中和反应的是 ( )
A. 硝酸银
B. 氧化铜
C. 熟石灰
D. 锌
A. 硝酸银
B. 氧化铜
C. 熟石灰
D. 锌
答案:
C
2. 中和反应与人们的日常生活、生产有密切的关系。
(1)由于人的胃里含有________,因此胃液分泌过多会引起胃病,服用含有氢氧化铝的药物可缓解病痛,其治疗的原理为____________________________(用化学方程式表示)。
(2)人被蚂蚁叮咬后皮肤会出现红肿和疼痛,这是因为蚂蚁叮咬时在皮肤内“注射”了蚁酸——甲酸。这时可以涂抹__________(填“肥皂水”或“食盐水”)以减轻疼痛。
(3)处理工厂的废水,如硫酸厂的污水中含有硫酸等物质,可用熟石灰进行处理,反应的化学方程式为______________________________。
(1)由于人的胃里含有________,因此胃液分泌过多会引起胃病,服用含有氢氧化铝的药物可缓解病痛,其治疗的原理为____________________________(用化学方程式表示)。
(2)人被蚂蚁叮咬后皮肤会出现红肿和疼痛,这是因为蚂蚁叮咬时在皮肤内“注射”了蚁酸——甲酸。这时可以涂抹__________(填“肥皂水”或“食盐水”)以减轻疼痛。
(3)处理工厂的废水,如硫酸厂的污水中含有硫酸等物质,可用熟石灰进行处理,反应的化学方程式为______________________________。
答案:
(1)盐酸(或HCl) $Al(OH)_3 + 3HCl = AlCl_3 + 3H_2O$
(2)肥皂水
(3)$Ca(OH)_2 + H_2SO_4 = CaSO_4 + 2H_2O$
(1)盐酸(或HCl) $Al(OH)_3 + 3HCl = AlCl_3 + 3H_2O$
(2)肥皂水
(3)$Ca(OH)_2 + H_2SO_4 = CaSO_4 + 2H_2O$
3. 某化学兴趣小组的同学在老师的指导下进行了氢氧化钠溶液与稀盐酸反应的探究,结合实验过程回答下列问题:
(1)老师建议滴加稀盐酸时要慢慢滴入,目的是________________。
(2)某同学认为向滴有酚酞的稀盐酸中滴加氢氧化钠溶液,当溶液恰好变为红色时,也可证明恰好完全反应,你同意这种观点吗,为什么?______________________________。
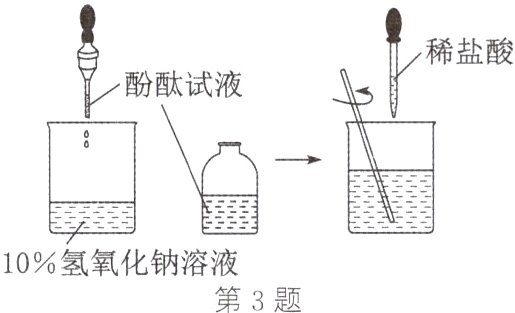
(1)老师建议滴加稀盐酸时要慢慢滴入,目的是________________。
(2)某同学认为向滴有酚酞的稀盐酸中滴加氢氧化钠溶液,当溶液恰好变为红色时,也可证明恰好完全反应,你同意这种观点吗,为什么?______________________________。

答案:
(1)控制稀盐酸用量,防止过量
(2)不同意,当溶液恰好变为红色时,所加氢氧化钠已过量
(1)控制稀盐酸用量,防止过量
(2)不同意,当溶液恰好变为红色时,所加氢氧化钠已过量
4. 如图是利用数字传感器得到的盐酸和氢氧化钙溶液反应过程中溶液pH的变化图像。
(1)在氢氧化钙溶液中滴入几滴无色酚酞试液,溶液呈________色;然后滴加盐酸至恰好完全反应时,溶液的pH________(填“大于”“小于”或“等于”)7。该反应的化学方程式为________________________。
(2)根据图中曲线判断,该反应是将__________(填“氢氧化钙溶液”或“盐酸”)滴入另一溶液中。
(3)当滴入溶液的体积为5 mL时,所得溶液中的溶质为______________(填化学式),此时烧杯内溶液如果未经处理直接倒入铸铁下水道,你认为可能造成的危害是____________________(用化学方程式表示)。
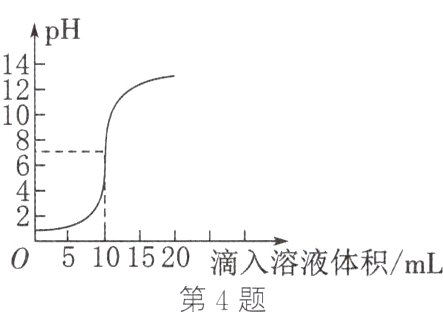
(1)在氢氧化钙溶液中滴入几滴无色酚酞试液,溶液呈________色;然后滴加盐酸至恰好完全反应时,溶液的pH________(填“大于”“小于”或“等于”)7。该反应的化学方程式为________________________。
(2)根据图中曲线判断,该反应是将__________(填“氢氧化钙溶液”或“盐酸”)滴入另一溶液中。
(3)当滴入溶液的体积为5 mL时,所得溶液中的溶质为______________(填化学式),此时烧杯内溶液如果未经处理直接倒入铸铁下水道,你认为可能造成的危害是____________________(用化学方程式表示)。

答案:
(1)红 等于 $2HCl + Ca(OH)_2 = CaCl_2 + 2H_2O$
(2)氢氧化钙溶液
(3)$CaCl_2$、HCl $Fe + 2HCl = FeCl_2 + H_2\uparrow$
(1)红 等于 $2HCl + Ca(OH)_2 = CaCl_2 + 2H_2O$
(2)氢氧化钙溶液
(3)$CaCl_2$、HCl $Fe + 2HCl = FeCl_2 + H_2\uparrow$
5. 实验室用溶质质量分数为20%的稀硫酸处理含Ba(OH)₂的废液。向100.0 g废液中加入稀硫酸至溶液恰好呈中性,最终得到2.33 g沉淀。请计算:
(1)配制490.0 g 20%的稀硫酸需溶质质量分数为98%的浓硫酸________g。
(2)废液中Ba(OH)₂的质量分数。
(1)配制490.0 g 20%的稀硫酸需溶质质量分数为98%的浓硫酸________g。
(2)废液中Ba(OH)₂的质量分数。
答案:
(1)100.0
(2)解:设100.0g废液中$Ba(OH)_2$的质量为$x$。$H_2SO_4 + Ba(OH)_2 = BaSO_4\downarrow + 2H_2O$
171 233
$x$ 2.33g
$\frac{171}{233}=\frac{x}{2.33g}$,$x = 1.71g$
废液中$Ba(OH)_2$的质量分数为$\frac{1.71g}{100.0g}×100\% = 1.71\%$。
答:废液中$Ba(OH)_2$的质量分数为1.71%。
解析:
(1)根据稀释前后溶质质量不变,设稀释前浓硫酸的质量为$m$,则$490.0g×20\% = m×98\%$,$m = 100.0g$。
(1)100.0
(2)解:设100.0g废液中$Ba(OH)_2$的质量为$x$。$H_2SO_4 + Ba(OH)_2 = BaSO_4\downarrow + 2H_2O$
171 233
$x$ 2.33g
$\frac{171}{233}=\frac{x}{2.33g}$,$x = 1.71g$
废液中$Ba(OH)_2$的质量分数为$\frac{1.71g}{100.0g}×100\% = 1.71\%$。
答:废液中$Ba(OH)_2$的质量分数为1.71%。
解析:
(1)根据稀释前后溶质质量不变,设稀释前浓硫酸的质量为$m$,则$490.0g×20\% = m×98\%$,$m = 100.0g$。
查看更多完整答案,请扫码查看


