2025年5年高考3年模拟高中化学选择性必修第三册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学选择性必修第三册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
15.我国科学家利用电催化实现了醇到醛的高选择性转化,其
转化关系如图所示。下列说法
错误的是
(
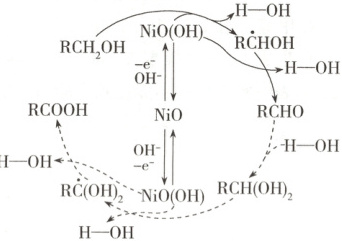
A.1 mol$\mathrm{RCH_2OH}$完全转化为
$\mathrm{RCOOH}$转移 4 mol 电子
B.$\mathrm{RCH_2OH→RCHOH}$时$\mathrm{NiO(OH)}$
被还原
C.$\mathrm{RCHO→RCH(OH)_2}$发生取代反应
D.要实现醇到醛高选择性转化,需控制条件,防止$\mathrm{RCHO→RCH(OH)_2}$
反应的发生
转化关系如图所示。下列说法
错误的是
(
C
)
A.1 mol$\mathrm{RCH_2OH}$完全转化为
$\mathrm{RCOOH}$转移 4 mol 电子
B.$\mathrm{RCH_2OH→RCHOH}$时$\mathrm{NiO(OH)}$
被还原
C.$\mathrm{RCHO→RCH(OH)_2}$发生取代反应
D.要实现醇到醛高选择性转化,需控制条件,防止$\mathrm{RCHO→RCH(OH)_2}$
反应的发生
答案:
15.C —CH₂OH中C元素化合价为 - 1价,—COOH中C元素化合价为 + 3价,1molRCH₂OH完全转化为RCOOH共失去4mol电子,故A正确;RCH₂OH→RCHOH时,RCH₂OH失去1个H原子,被氧化,则NiO(OH)被还原,镍元素由 + 3价变为NiO中 + 2价,故B正确;RCHO+H₂O→RCH(OH)₂,发生加成反应,故C错误;从反应流程可看出,当RCH₂OH经过两步反应生成RCHO后,RCHO可能会继续转化,最终生成RCOOH,则要实现醇到醛高选择性转化,需控制条件,防止醛继续反应,故D正确。
16.(10 分)乙醇是一种重要的化工原料,以乙醇为原料衍生出的部分化工
产品如图所示:

回答下列问题:
(1)A 的结构简式为
(2)B 的化学名称是
(3)C 中含氧官能团的名称为
(4)E 是一种常见的塑料,由 D 合成 E 的化学方程式为
(5)由乙醇生成 F 的反应类型为
产品如图所示:

回答下列问题:
(1)A 的结构简式为
CH₃COOH
。(2)B 的化学名称是
乙酸乙酯
。(3)C 中含氧官能团的名称为
羟基
。(4)E 是一种常见的塑料,由 D 合成 E 的化学方程式为
nCHCl=CH₂一定条件→[CH—CH₂]n  Cl
Cl
。 Cl
Cl(5)由乙醇生成 F 的反应类型为
消去反应
。
答案:
16.答案 (每空2分)
(1)CH₃COOH
(2)乙酸乙酯
(3)羟基
(4)nCHCl=CH₂一定条件→[CH—CH₂]n
Cl
(5)消去反应
解析 根据题图转化可推知A为CH₃COOH,B为CH₃COOCH₂CH₃,C为CH₂ClCH₂OH,D为CHCl=CH₂,E为[CH—CH₂]n,F为CH₂=CH₂。
Cl
16.答案 (每空2分)
(1)CH₃COOH
(2)乙酸乙酯
(3)羟基
(4)nCHCl=CH₂一定条件→[CH—CH₂]n

Cl
(5)消去反应
解析 根据题图转化可推知A为CH₃COOH,B为CH₃COOCH₂CH₃,C为CH₂ClCH₂OH,D为CHCl=CH₂,E为[CH—CH₂]n,F为CH₂=CH₂。
Cl
17.(13 分)乙酸乙酯是无色、具有水果香味的液体,沸点为 77.2 ℃,实验室
某次制取乙酸乙酯用 14.3 mL 冰醋酸、23 mL 95%乙醇溶液,还用到浓
硫酸、饱和碳酸钠溶液以及极易与乙醇结合成$\mathrm{CaCl_2·6C_2H_5OH}$的饱
和氯化钙溶液。装置如图所示(烧杯、部分夹持装置、温度计已略去)。

实验步骤:
①先向蒸馏烧瓶内注入少量乙醇和浓硫酸后摇匀,再
将剩下的所有乙醇和冰醋
酸注入分液漏斗里待用。
②加热油浴保温 135 ~
145 ℃。
③将分液漏斗中的液体缓缓滴入蒸馏烧瓶中,调节加料速率使蒸出酯
的速率与进料速率大体相等,直到加料完成。
④保持油浴温度一段时间,至不再有液体流出后,停止加热。
⑤取下 a,将一定量饱和$\mathrm{Na_2CO_3}$溶液分批少量多次地加到馏出液里,
边加边摇荡,至无气泡产生。
⑥将⑤的液体混合物分液,弃去水层。
⑦将饱和$\mathrm{CaCl_2}$溶液(适量)加入分液漏斗中,振荡一段时间后静置,放
出水层(废液)。
⑧分液漏斗中得到的是初步提纯的乙酸乙酯粗品。
试回答:
(1)实验中浓硫酸的主要作用是
(2)用过量乙醇的主要目的是
(3)用饱和$\mathrm{Na_2CO_3}$溶液洗涤粗酯的目的是
代替饱和$\mathrm{Na_2CO_3}$溶液,引起的后果是
(4)用饱和$\mathrm{CaCl_2}$溶液洗涤粗酯的目的是
(5)为什么操作③要使加料与馏出的速率大致相等?
(6)在⑧中所得到的粗酯里含有的杂质主要是
(7)为什么 a 要用长导管与室外相通?
某次制取乙酸乙酯用 14.3 mL 冰醋酸、23 mL 95%乙醇溶液,还用到浓
硫酸、饱和碳酸钠溶液以及极易与乙醇结合成$\mathrm{CaCl_2·6C_2H_5OH}$的饱
和氯化钙溶液。装置如图所示(烧杯、部分夹持装置、温度计已略去)。

实验步骤:
①先向蒸馏烧瓶内注入少量乙醇和浓硫酸后摇匀,再
将剩下的所有乙醇和冰醋
酸注入分液漏斗里待用。
②加热油浴保温 135 ~
145 ℃。
③将分液漏斗中的液体缓缓滴入蒸馏烧瓶中,调节加料速率使蒸出酯
的速率与进料速率大体相等,直到加料完成。
④保持油浴温度一段时间,至不再有液体流出后,停止加热。
⑤取下 a,将一定量饱和$\mathrm{Na_2CO_3}$溶液分批少量多次地加到馏出液里,
边加边摇荡,至无气泡产生。
⑥将⑤的液体混合物分液,弃去水层。
⑦将饱和$\mathrm{CaCl_2}$溶液(适量)加入分液漏斗中,振荡一段时间后静置,放
出水层(废液)。
⑧分液漏斗中得到的是初步提纯的乙酸乙酯粗品。
试回答:
(1)实验中浓硫酸的主要作用是
催化剂、吸水剂
。(2)用过量乙醇的主要目的是
使平衡正向移动,增大乙酸乙酯的产率
。(3)用饱和$\mathrm{Na_2CO_3}$溶液洗涤粗酯的目的是
消耗粗酯中的乙酸,溶解粗酯中的乙醇,乙酸乙酯在饱和Na₂CO₃溶液中的溶解度较小,便于分层得到酯
。如果用$\mathrm{NaOH}$浓溶液代替饱和$\mathrm{Na_2CO_3}$溶液,引起的后果是
乙酸乙酯水解
。(4)用饱和$\mathrm{CaCl_2}$溶液洗涤粗酯的目的是
除去乙酸乙酯中的乙醇
。(5)为什么操作③要使加料与馏出的速率大致相等?
让产生的乙酸乙酯及时蒸馏出来,有利于反应正向进行
。(6)在⑧中所得到的粗酯里含有的杂质主要是
水
。(7)为什么 a 要用长导管与室外相通?
可使实验中产生的SO₂等有毒气体排出,也有利于乙酸乙酯等液体流入a,并使a中的压强内外一致
。
答案:
17.答案 (除注明外,每空2分)
(1)催化剂、吸水剂(1分)
(2)使平衡正向移动,增大乙酸乙酯的产率(1分)
(3)消耗粗酯中的乙酸,溶解粗酯中的乙醇,乙酸乙酯在饱和Na₂CO₃溶液中的溶解度较小,便于分层得到酯 乙酸乙酯水解
(4)除去乙酸乙酯中的乙醇
(5)让产生的乙酸乙酯及时蒸馏出来,有利于反应正向进行
(6)水(1分)
(7)可使实验中产生的SO₂等有毒气体排出,也有利于乙酸乙酯等液体流入a,并使a中的压强内外一致
解析
(1)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯的方向移动,则浓硫酸的主要作用为催化剂、吸水剂。
(2)乙酸与乙醇发生酯化反应,该反应属于可逆反应,过量乙醇可以使平衡正向移动,增大乙酸乙酯的产率。
(3)用饱和Na₂CO₃溶液洗涤粗酯的目的是消耗粗酯中的乙酸,溶解粗酯中的乙醇,乙酸乙酯在饱和Na₂CO₃溶液中的溶解度较小,便于分层得到酯;如果用NaOH浓溶液代替饱和Na₂CO₃溶液,会使乙酸乙酯水解,使产率降低。
(4)饱和氯化钙溶液极易与乙醇结合成CaCl₂·6C₂H₅OH,因此饱和CaCl₂溶液可以吸收乙酸乙酯中残留的乙醇。
(5)加料与馏出的速率大致相等,让产生的乙酸乙酯及时蒸馏出来,有利于反应正向进行。
(6)操作⑦中用饱和CaCl₂溶液除去粗酯中的乙醇,萃取后得到乙酸乙酯粗品,乙酸乙酯粗品中含有水,故杂质主要为水。
(7)用长导管与室外相通,可使实验中产生的SO₂等有毒气体排出,也有利于乙酸乙酯等液体流入a,并使a中的压强内外一致。
(1)催化剂、吸水剂(1分)
(2)使平衡正向移动,增大乙酸乙酯的产率(1分)
(3)消耗粗酯中的乙酸,溶解粗酯中的乙醇,乙酸乙酯在饱和Na₂CO₃溶液中的溶解度较小,便于分层得到酯 乙酸乙酯水解
(4)除去乙酸乙酯中的乙醇
(5)让产生的乙酸乙酯及时蒸馏出来,有利于反应正向进行
(6)水(1分)
(7)可使实验中产生的SO₂等有毒气体排出,也有利于乙酸乙酯等液体流入a,并使a中的压强内外一致
解析
(1)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯的方向移动,则浓硫酸的主要作用为催化剂、吸水剂。
(2)乙酸与乙醇发生酯化反应,该反应属于可逆反应,过量乙醇可以使平衡正向移动,增大乙酸乙酯的产率。
(3)用饱和Na₂CO₃溶液洗涤粗酯的目的是消耗粗酯中的乙酸,溶解粗酯中的乙醇,乙酸乙酯在饱和Na₂CO₃溶液中的溶解度较小,便于分层得到酯;如果用NaOH浓溶液代替饱和Na₂CO₃溶液,会使乙酸乙酯水解,使产率降低。
(4)饱和氯化钙溶液极易与乙醇结合成CaCl₂·6C₂H₅OH,因此饱和CaCl₂溶液可以吸收乙酸乙酯中残留的乙醇。
(5)加料与馏出的速率大致相等,让产生的乙酸乙酯及时蒸馏出来,有利于反应正向进行。
(6)操作⑦中用饱和CaCl₂溶液除去粗酯中的乙醇,萃取后得到乙酸乙酯粗品,乙酸乙酯粗品中含有水,故杂质主要为水。
(7)用长导管与室外相通,可使实验中产生的SO₂等有毒气体排出,也有利于乙酸乙酯等液体流入a,并使a中的压强内外一致。
查看更多完整答案,请扫码查看


