2026年金考卷特快专递高中化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年金考卷特快专递高中化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
14. (15 分) 砷的化合物可用于半导体领域,如我国“天宫”空间站的核心舱“天和号”采用砷化镓薄膜电池来供电。
(1) 一种从酸性高浓度含砷废水[砷主要以亚砷酸($\mathrm{H_3AsO_3}$)形式存在]中回收砷的工艺流程如图。

已知:Ⅰ. $\mathrm{As_2S_3 + 6NaOH \xlongequal\ Na_3AsO_3 + Na_3AsS_3 + 3H_2O}$;
Ⅱ. $\mathrm{As_2S_3(s) + 3S^{2-}(aq) \rightleftharpoons 2AsS^{3-}_3(aq)}$;
Ⅲ. 砷酸($\mathrm{H_3AsO_4}$)是一种弱酸,在酸性条件下有强氧化性,能被$\mathrm{SO_2}$还原。
①基态 As 原子的核外电子排布式为
②“沉砷”过程中$\mathrm{FeS}$不可以用过量的$\mathrm{Na_2S}$替换,请从平衡移动的角度解释原因:
③向滤液Ⅱ中通入氧气进行“氧化脱硫”,请写出反应的化学方程式:
④用$\mathrm{SO_2}$进行“还原”过程,请写出其反应的离子方程式: 。
。
(2) 含砷废水常见于采矿、半导体等工业,部分砷的化合物有毒,因此需除去废水中的砷。
①氧化吸附法。已知:常温下,pH > 7 时,吸附剂表面带负电,pH 越大,吸附剂表面带的负电荷越多;pH < 7 时,吸附剂表面带正电,pH 越小,吸附剂表面带的正电荷越多。
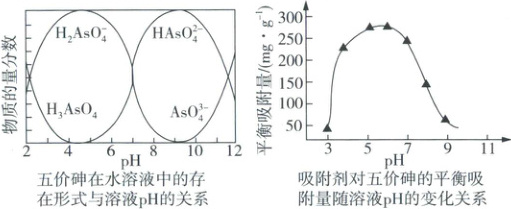
结合题图分析当溶液 pH 介于 7~9,吸附剂对五价砷的平衡吸附量随 pH 的升高而下降的原因:
②化学沉降法。向废水中先加入适量氧化剂,再加入生石灰调节 pH,将砷元素全部转化为$\mathrm{Ca_3(AsO_4)_2}$沉淀。若沉降后上层清液中$c(\mathrm{Ca^{2+}})$为$2×10^{-3}$ mol·L⁻¹,试计算该废水中的 As 含量是否符合排放标准
(1) 一种从酸性高浓度含砷废水[砷主要以亚砷酸($\mathrm{H_3AsO_3}$)形式存在]中回收砷的工艺流程如图。

已知:Ⅰ. $\mathrm{As_2S_3 + 6NaOH \xlongequal\ Na_3AsO_3 + Na_3AsS_3 + 3H_2O}$;
Ⅱ. $\mathrm{As_2S_3(s) + 3S^{2-}(aq) \rightleftharpoons 2AsS^{3-}_3(aq)}$;
Ⅲ. 砷酸($\mathrm{H_3AsO_4}$)是一种弱酸,在酸性条件下有强氧化性,能被$\mathrm{SO_2}$还原。
①基态 As 原子的核外电子排布式为
1s²2s²2p⁶3s²3p⁶3d¹⁰4s²4p³
。②“沉砷”过程中$\mathrm{FeS}$不可以用过量的$\mathrm{Na_2S}$替换,请从平衡移动的角度解释原因:
加入过量的Na₂S,溶液中c(S²⁻)增大,As₂S₃(s) + 3S²⁻(aq) ⇌ 2AsS₃³⁻(aq)平衡正向移动,不利于沉砷
。③向滤液Ⅱ中通入氧气进行“氧化脱硫”,请写出反应的化学方程式:
3Na₃AsS₃ + 6NaOH = Na₃AsO₃ + 3Na₂S + 3H₂O
。④用$\mathrm{SO_2}$进行“还原”过程,请写出其反应的离子方程式:
2H₃AsO₄ + 2SO₂ = As₂O₃ + 2SO₄²⁻ + 4H⁺ + H₂O
,工业生产中也可以用雌黄($\mathrm{As_2S_3}$)代替$\mathrm{SO_2}$作还原剂。已知雌黄($\mathrm{As_2S_3}$)中没有$\pi$键且各原子最外层均达 8 电子稳定结构,试画出雌黄($\mathrm{As_2S_3}$)的结构图:
(2) 含砷废水常见于采矿、半导体等工业,部分砷的化合物有毒,因此需除去废水中的砷。
①氧化吸附法。已知:常温下,pH > 7 时,吸附剂表面带负电,pH 越大,吸附剂表面带的负电荷越多;pH < 7 时,吸附剂表面带正电,pH 越小,吸附剂表面带的正电荷越多。

结合题图分析当溶液 pH 介于 7~9,吸附剂对五价砷的平衡吸附量随 pH 的升高而下降的原因:
pH介于7~9,随pH升高,H₃AsO₃转变为H₂AsO₃⁻,吸附剂表面所带负电荷增多,静电斥力增加,吸附量下降
。②化学沉降法。向废水中先加入适量氧化剂,再加入生石灰调节 pH,将砷元素全部转化为$\mathrm{Ca_3(AsO_4)_2}$沉淀。若沉降后上层清液中$c(\mathrm{Ca^{2+}})$为$2×10^{-3}$ mol·L⁻¹,试计算该废水中的 As 含量是否符合排放标准
c(Ca²⁺) = 2 × 10⁻³ mol · L⁻¹,K_sp[Ca₃(AsO₄)₂] = c³(Ca²⁺) · c²(AsO₄³⁻),故c(AsO₄³⁻) = 1 × 10⁻⁵ mol · L⁻¹,该废水中As的质量浓度为1 × 10⁻⁵ mol · L⁻¹ × 75g · mol⁻¹ × 10³mg · g⁻¹ = 0.75mg · L⁻¹;0.75mg · L⁻¹>0.50mg · L⁻¹,未达到排放标准
(写出计算过程)。(已知:废水中 As 的质量浓度不超过 0.50 mg·L⁻¹方可达到排放标准。$K_\mathrm{sp}[\mathrm{Ca_3(AsO_4)_2}] = 8×10^{-19}$)
答案:
14.
(1)①1s²2s²2p⁶3s²3p⁶3d¹⁰4s²4p³(2分)
②加入过量的Na₂S,溶液中c(S²⁻)增大,As₂S₃(s) + 3S²⁻(aq) ⇌ 2AsS₃³⁻(aq)平衡正向移动,不利于沉砷(2分)
③3Na₃AsS₃ + 6NaOH = Na₃AsO₃ + 3Na₂S + 3H₂O(2分)
④2H₃AsO₄ + 2SO₂ = As₂O₃ + 2SO₄²⁻ + 4H⁺ + H₂O(2分)
 S(2分)
S(2分)
(2)①pH介于7~9,随pH升高,H₃AsO₃转变为H₂AsO₃⁻,吸附剂表面所带负电荷增多,静电斥力增加,吸附量下降(2分)
②c(Ca²⁺) = 2 × 10⁻³ mol · L⁻¹,K_sp[Ca₃(AsO₄)₂] = c³(Ca²⁺) · c²(AsO₄³⁻),故c(AsO₄³⁻) = 1 × 10⁻⁵ mol · L⁻¹(1分),该废水中As的质量浓度为1 × 10⁻⁵ mol · L⁻¹ × 75g · mol⁻¹ × 10³mg · g⁻¹ = 0.75mg · L⁻¹(1分);0.75mg · L⁻¹>0.50mg · L⁻¹,未达到排放标准(1分)
砷的回收、物质结构、元素及其化合物的转化、化学反应原理
(1)①As是第四周期第VA族元素,故基态As原子的核外电子排布式为1s²2s²2p⁶3s²3p⁶3d¹⁰4s²4p³。②结合已知信息Ⅱ中反应As₂S₃(s) + 3S²⁻(aq) ⇌ 2AsS₃³⁻(aq)可知,加入过量的Na₂S时,溶液中c(S²⁻)增大,该平衡正向移动,不利于沉砷,故“沉砷”过程中FeS不可以用过量的Na₂S替换。③根据已知信息Ⅰ中反应As₂S₃ + 6NaOH = Na₃AsO₃ + Na₃AsS₃ + 3H₂O可知,滤液Ⅱ中含硫化合物是Na₃AsS₃,由题图知,通入氧气进行“氧化脱硫”时,Na₃AsS₃转化为Na₃AsO₄和S,故反应的化学方程式为Na₃AsS₃ + 2O₂ = Na₃AsO₄ + 3S↓。④根据已知信息Ⅲ可知,砷酸(H₃AsO₄)是一种弱酸,在离子方程式中应写成化学式,其在酸性条件下有强氧化性,能被SO₂还原,故反应的离子方程式是2H₃AsO₄ + 2SO₂ = As₂O₃ + 2SO₄²⁻ + 4H⁺ + H₂O。根据雌黄(As₂S₃)中没有π键且各原子最外层均达8电子稳定结构可知,As形成3个共价键、S形成2个共价键,故雌黄(As₂S₃)的结构图是 。
。
(2)①由题图知,溶液pH介于7~9时,随pH升高,H₃AsO₃转变为H₂AsO₃⁻,吸附剂表面所带负电荷增多,静电斥力增加,故吸附量下降。②由题干条件可知,c(Ca²⁺) = 2 × 10⁻³ mol · L⁻¹,又K_sp[Ca₃(AsO₄)₂] = c³(Ca²⁺) · c²(AsO₄³⁻),计算可得c(AsO₄³⁻) = 1 × 10⁻⁵ mol · L⁻¹,该废水中As的质量浓度为1 × 10⁻⁵ mol · L⁻¹ × 75 × 10³mg · mol⁻¹ = 0.75mg · L⁻¹,0.75mg · L⁻¹>0.50mg · L⁻¹,故未达到排放标准。
14.
(1)①1s²2s²2p⁶3s²3p⁶3d¹⁰4s²4p³(2分)
②加入过量的Na₂S,溶液中c(S²⁻)增大,As₂S₃(s) + 3S²⁻(aq) ⇌ 2AsS₃³⁻(aq)平衡正向移动,不利于沉砷(2分)
③3Na₃AsS₃ + 6NaOH = Na₃AsO₃ + 3Na₂S + 3H₂O(2分)
④2H₃AsO₄ + 2SO₂ = As₂O₃ + 2SO₄²⁻ + 4H⁺ + H₂O(2分)
 S(2分)
S(2分)(2)①pH介于7~9,随pH升高,H₃AsO₃转变为H₂AsO₃⁻,吸附剂表面所带负电荷增多,静电斥力增加,吸附量下降(2分)
②c(Ca²⁺) = 2 × 10⁻³ mol · L⁻¹,K_sp[Ca₃(AsO₄)₂] = c³(Ca²⁺) · c²(AsO₄³⁻),故c(AsO₄³⁻) = 1 × 10⁻⁵ mol · L⁻¹(1分),该废水中As的质量浓度为1 × 10⁻⁵ mol · L⁻¹ × 75g · mol⁻¹ × 10³mg · g⁻¹ = 0.75mg · L⁻¹(1分);0.75mg · L⁻¹>0.50mg · L⁻¹,未达到排放标准(1分)
砷的回收、物质结构、元素及其化合物的转化、化学反应原理
(1)①As是第四周期第VA族元素,故基态As原子的核外电子排布式为1s²2s²2p⁶3s²3p⁶3d¹⁰4s²4p³。②结合已知信息Ⅱ中反应As₂S₃(s) + 3S²⁻(aq) ⇌ 2AsS₃³⁻(aq)可知,加入过量的Na₂S时,溶液中c(S²⁻)增大,该平衡正向移动,不利于沉砷,故“沉砷”过程中FeS不可以用过量的Na₂S替换。③根据已知信息Ⅰ中反应As₂S₃ + 6NaOH = Na₃AsO₃ + Na₃AsS₃ + 3H₂O可知,滤液Ⅱ中含硫化合物是Na₃AsS₃,由题图知,通入氧气进行“氧化脱硫”时,Na₃AsS₃转化为Na₃AsO₄和S,故反应的化学方程式为Na₃AsS₃ + 2O₂ = Na₃AsO₄ + 3S↓。④根据已知信息Ⅲ可知,砷酸(H₃AsO₄)是一种弱酸,在离子方程式中应写成化学式,其在酸性条件下有强氧化性,能被SO₂还原,故反应的离子方程式是2H₃AsO₄ + 2SO₂ = As₂O₃ + 2SO₄²⁻ + 4H⁺ + H₂O。根据雌黄(As₂S₃)中没有π键且各原子最外层均达8电子稳定结构可知,As形成3个共价键、S形成2个共价键,故雌黄(As₂S₃)的结构图是
 。
。(2)①由题图知,溶液pH介于7~9时,随pH升高,H₃AsO₃转变为H₂AsO₃⁻,吸附剂表面所带负电荷增多,静电斥力增加,故吸附量下降。②由题干条件可知,c(Ca²⁺) = 2 × 10⁻³ mol · L⁻¹,又K_sp[Ca₃(AsO₄)₂] = c³(Ca²⁺) · c²(AsO₄³⁻),计算可得c(AsO₄³⁻) = 1 × 10⁻⁵ mol · L⁻¹,该废水中As的质量浓度为1 × 10⁻⁵ mol · L⁻¹ × 75 × 10³mg · mol⁻¹ = 0.75mg · L⁻¹,0.75mg · L⁻¹>0.50mg · L⁻¹,故未达到排放标准。
15. (15 分) 化合物 H 是一种治疗肠道疾病药物的中间体,其合成路线如图。
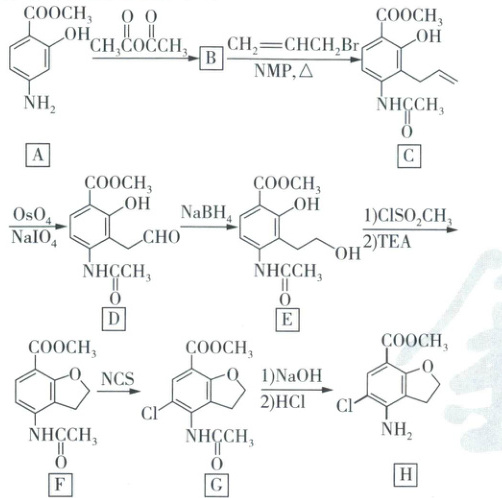
(1) G 中含氧官能团的名称为酯基、
(2) E 生成 F 的反应类型为
(3) 化合物 B 的结构简式为 。
。
(4) 写出同时满足下列条件的 F 的一种同分异构体的结构简式: 。
。
①能发生银镜反应;
②苯环上一取代物只有一种;
③含有 3 种不同化学环境的氢原子。
(5) 已知:$\mathrm{2CH_3CHO \xrightarrow[△]{催化剂} CH_3CH=CHCHO + H_2O}$。
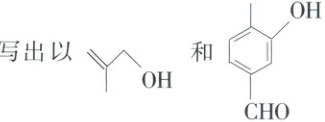
写出以 和 为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)。

(1) G 中含氧官能团的名称为酯基、
酰胺基、醚键
。(2) E 生成 F 的反应类型为
取代反应
。(3) 化合物 B 的结构简式为

(4) 写出同时满足下列条件的 F 的一种同分异构体的结构简式:

①能发生银镜反应;
②苯环上一取代物只有一种;
③含有 3 种不同化学环境的氢原子。
(5) 已知:$\mathrm{2CH_3CHO \xrightarrow[△]{催化剂} CH_3CH=CHCHO + H_2O}$。

写出以 和 为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)。

答案:
15.
(1)酰胺基、醚键(2分)
(2)取代反应(2分)
 (3分)
(3分)
(4) 或(3分)
或(3分)
(5)以 和
和 为原料制备
为原料制备
根据碳原子数目可知,需利用B→C的反应将 连接到
连接到 中—OH的邻位碳原子上,而
中—OH的邻位碳原子上,而 中羟基需先转化为溴原子后才能进行该反应,反应生成的
中羟基需先转化为溴原子后才能进行该反应,反应生成的 比
比 多一个碳原子,结合已知反应知,可先利用C→D的反应将
多一个碳原子,结合已知反应知,可先利用C→D的反应将 转化为
转化为 ,在催化剂、加热条件下转化为
,在催化剂、加热条件下转化为 后与H₂发生加成反应即可得到目标产物。
后与H₂发生加成反应即可得到目标产物。
15.
(1)酰胺基、醚键(2分)
(2)取代反应(2分)
 (3分)
(3分)(4)
 或(3分)
或(3分)(5)以
 和
和 为原料制备
为原料制备根据碳原子数目可知,需利用B→C的反应将
 连接到
连接到 中—OH的邻位碳原子上,而
中—OH的邻位碳原子上,而 中羟基需先转化为溴原子后才能进行该反应,反应生成的
中羟基需先转化为溴原子后才能进行该反应,反应生成的 比
比 多一个碳原子,结合已知反应知,可先利用C→D的反应将
多一个碳原子,结合已知反应知,可先利用C→D的反应将 转化为
转化为 ,在催化剂、加热条件下转化为
,在催化剂、加热条件下转化为 后与H₂发生加成反应即可得到目标产物。
后与H₂发生加成反应即可得到目标产物。 16. ☆(16 分)通过处理废旧磁性合金钕铁硼($\mathrm{Nd_2Fe_{14}B}$)可回收钕与铁,如图 1。
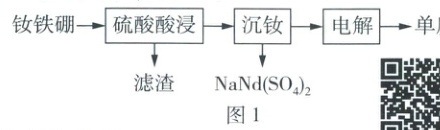
Ⅰ. 湿法分离
(1) 向钕铁硼中加入硫酸,钕、铁分别转化为$\mathrm{Nd^{3+}}$、$\mathrm{Fe^{2+}}$进入滤液。酸浸过程中溶液温度、pH 随时间变化如图 2 所示。已知:常温下,$K_\mathrm{a2}(\mathrm{H_2SO_4}) = 10^{-2}$;$\mathrm{HSO^-_4(aq) \rightleftharpoons H^+(aq) + SO^{2-}_4(aq)\ \ \ \Delta H < 0}$。
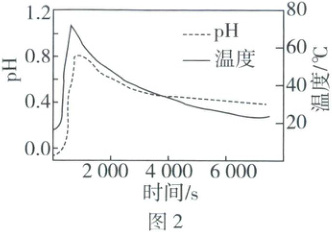
①常温下,pH = 2.0 的硫酸中$\frac{c(\mathrm{HSO^-_4})}{c(\mathrm{SO^{2-}_4})} =$
②酸浸阶段溶液的 pH 迅速上升后又下降的主要原因是
(2) 向酸浸后的滤液中加入 NaOH 溶液,可将$\mathrm{Nd^{3+}}$转化为$\mathrm{NaNd(SO_4)_2}$沉淀分离。
①若加入 NaOH 溶液过多,放置时间过长可能会产生$\mathrm{Fe(OH)_2}$或 FeOOH。$\mathrm{Fe^{2+}}$转化为 FeOOH 的离子方程式为
②检验所得$\mathrm{NaNd(SO_4)_2}$沉淀中是否含有铁元素的实验方案为
(3) 将“沉钕”后过滤所得的滤液(含$\mathrm{FeSO_4}$、$\mathrm{H_2SO_4}$)电解可获得铁。为提高阴极的电解效率,可加入少量具有还原性的弱酸盐柠檬酸钠,其作用是
Ⅱ. 干法分离
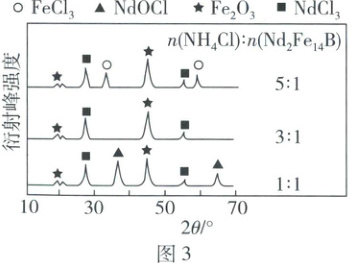
(4) 不同$n(\mathrm{NH_4Cl}):n(\mathrm{Nd_2Fe_{14}B})$的固体混合物在空气中焙烧所得固体物质的 X 射线衍射图(可用于判断某晶态物质是否存在)如图 3 所示。已知:$\mathrm{Nd_2(C_2O_4)_3}$、$\mathrm{Fe_2(C_2O_4)_3}$难溶于水,$\mathrm{NdOCl}$微溶于水,$\mathrm{NdCl_3}$可溶于水。请补充完整以$\mathrm{Nd_2Fe_{14}B}$为原料制备$\mathrm{Nd_2(C_2O_4)_3}$的实验方案:将$n(\mathrm{NH_4Cl}):n(\mathrm{Nd_2Fe_{14}B}) =$

Ⅰ. 湿法分离
(1) 向钕铁硼中加入硫酸,钕、铁分别转化为$\mathrm{Nd^{3+}}$、$\mathrm{Fe^{2+}}$进入滤液。酸浸过程中溶液温度、pH 随时间变化如图 2 所示。已知:常温下,$K_\mathrm{a2}(\mathrm{H_2SO_4}) = 10^{-2}$;$\mathrm{HSO^-_4(aq) \rightleftharpoons H^+(aq) + SO^{2-}_4(aq)\ \ \ \Delta H < 0}$。

①常温下,pH = 2.0 的硫酸中$\frac{c(\mathrm{HSO^-_4})}{c(\mathrm{SO^{2-}_4})} =$
1
。②酸浸阶段溶液的 pH 迅速上升后又下降的主要原因是
反应消耗H⁺,温度升高抑制HSO₃⁻的电离,降温后又促进HSO₃⁻的电离
。(2) 向酸浸后的滤液中加入 NaOH 溶液,可将$\mathrm{Nd^{3+}}$转化为$\mathrm{NaNd(SO_4)_2}$沉淀分离。
①若加入 NaOH 溶液过多,放置时间过长可能会产生$\mathrm{Fe(OH)_2}$或 FeOOH。$\mathrm{Fe^{2+}}$转化为 FeOOH 的离子方程式为
4Fe²⁺ + O₂ + 8OH⁻ = 4FeOOH↓ + 2H₂O
。②检验所得$\mathrm{NaNd(SO_4)_2}$沉淀中是否含有铁元素的实验方案为
取少量沉淀,加入足量盐酸溶解,再加入H₂O₂溶液,滴加KSCN溶液,若有红色出现,说明含有铁元素
。(3) 将“沉钕”后过滤所得的滤液(含$\mathrm{FeSO_4}$、$\mathrm{H_2SO_4}$)电解可获得铁。为提高阴极的电解效率,可加入少量具有还原性的弱酸盐柠檬酸钠,其作用是
柠檬酸根离子与H⁺结合,减少H⁺在阴极放电;防止Fe²⁺被氧化为Fe³⁺
。Ⅱ. 干法分离
(4) 不同$n(\mathrm{NH_4Cl}):n(\mathrm{Nd_2Fe_{14}B})$的固体混合物在空气中焙烧所得固体物质的 X 射线衍射图(可用于判断某晶态物质是否存在)如图 3 所示。已知:$\mathrm{Nd_2(C_2O_4)_3}$、$\mathrm{Fe_2(C_2O_4)_3}$难溶于水,$\mathrm{NdOCl}$微溶于水,$\mathrm{NdCl_3}$可溶于水。请补充完整以$\mathrm{Nd_2Fe_{14}B}$为原料制备$\mathrm{Nd_2(C_2O_4)_3}$的实验方案:将$n(\mathrm{NH_4Cl}):n(\mathrm{Nd_2Fe_{14}B}) =$
3:1
的固体混合物在坩埚中焙烧,冷却至室温后将固体转移至烧杯中,加水充分浸取,过滤,向滤液中加入(NH₄)₂C₂O₄溶液,静置后向上层清液中继续滴加(NH₄)₂C₂O₄溶液,无浑浊,过滤
,洗涤,干燥[须使用的试剂:($\mathrm{NH_4})_2C_2O_4$溶液]。
答案:
16.
(1)①1(1分) ②反应消耗H⁺,温度升高抑制HSO₃⁻的电离(2分),降温后又促进HSO₃⁻的电离(1分)
(2)①4Fe²⁺ + O₂ + 8OH⁻ = 4FeOOH↓ + 2H₂O(2分)
②取少量沉淀,加入足量盐酸溶解,再加入H₂O₂溶液,滴加KSCN溶液,若有红色出现,说明含有铁元素(2分)
(3)柠檬酸根离子与H⁺结合,减少H⁺在阴极放电;防止Fe²⁺被氧化为Fe³⁺(2分)
(4)3:1(1分) 加水充分浸取(1分),过滤(1分),向滤液中加入(NH₄)₂C₂O₄溶液,静置后向上层清液中继续滴加(NH₄)₂C₂O₄溶液,无浑浊(2分),过滤(1分)
处理废旧磁性合金钕铁硼回收钕与铁的实验
(1)①常温下,pH = 2.0时,c(H⁺) = 10⁻² mol · L⁻¹,K_a2(H₂SO₄) = $\frac{c(SO₃²⁻) · c(H⁺)}{c(HSO₄⁻)}$ = 10⁻².⁹,故$\frac{c(HSO₄⁻)}{c(SO₃²⁻)}$ = 1。②钕铁硼酸浸时消耗H⁺,c(H⁺)减小,随着反应温度升高,HSO₄⁻(aq) ⇌ H⁺(aq) + SO₄²⁻(aq)平衡逆向移动,抑制HSO₄⁻的电离,故溶液的pH迅速上升;降温后又促进HSO₄⁻的电离,故溶液的pH下降。
(2)①溶液中的Fe²⁺与过多的NaOH反应生成Fe(OH)₂,放置时间过长会与空气中的O₂产生FeOOH,故反应的离子方程式为4Fe²⁺ + O₂ + 8OH⁻ = 4FeOOH↓ + 2H₂O。②检验所得NaNd(SO₄)₂沉淀中是否含有铁元素时,可将沉淀中的铁元素转化为Fe³⁺,用KSCN溶液鉴别。
(3)过滤所得的滤液中含FeSO₄、H₂SO₄,电解时Fe²⁺、H⁺均能在阴极放电,为提高阴极的电解效率,需抑制H⁺放电,且防止Fe²⁺被氧化为Fe³⁺,故加入少量具有还原性的弱酸盐柠檬酸钠,既能防止Fe²⁺被氧化为Fe³⁺,且柠檬酸根离子(弱酸根离子)与H⁺结合,又能抑制H⁺在阴极放电。
(4)由题意知,该实验利用NdCl₃和(NH₄)₂C₂O₄之间的反应得到Nd₂(C₂O₄)₃,为了提高产品产率和纯度,需使Nd₂Fe₁₄B中的Nd元素完全转化为可溶于水的NdCl₃、使Fe元素完全转化为Fe₂O₃固体除去,则n(NH₄Cl):n(Nd₂Fe₁₄B) = 3:1时符合要求;将焙烧、冷却后的固体转移到烧杯中后,加水浸取,过滤除去Fe₂O₃,得到NdCl₃溶液,向NdCl₃溶液中加入(NH₄)₂C₂O₄溶液充分反应,得到Nd₂(C₂O₄)₃沉淀,为检验NdCl₃是否完全反应,可静置后向上层清液中滴加(NH₄)₂C₂O₄溶液,若无浑浊产生,则反应完全,过滤、洗涤、干燥即可获得Nd₂(C₂O₄)₃。
考情速递 数字赋能实验之结合X射线衍射设计实验方案 2025年新课程标准提出“数字赋能实验”,而实验题在高考化学试题中属于必考题型,常结合基础操作、现象研究、方案设计等多角度考查基础知识、反应原理,培养考生的实验探究能力。如2025年广东卷第17题设计实验方案测定HClO的K_a,江苏卷第16题要求补充实验方案比较含氯FeOOH在NaOH溶液与蒸馏水中浸泡的脱氯效果,本题结合X射线衍射图来选择n(NH₄Cl)和n(Nd₂Fe₁₄B)的最佳比例,进而补充以Nd₂Fe₁₄B为原料制备Nd₂(C₂O₄)₃的实验方案,考查形式创新,增强了实验探究的开放性,有利于提升考生解决实际问题的能力。
(1)①1(1分) ②反应消耗H⁺,温度升高抑制HSO₃⁻的电离(2分),降温后又促进HSO₃⁻的电离(1分)
(2)①4Fe²⁺ + O₂ + 8OH⁻ = 4FeOOH↓ + 2H₂O(2分)
②取少量沉淀,加入足量盐酸溶解,再加入H₂O₂溶液,滴加KSCN溶液,若有红色出现,说明含有铁元素(2分)
(3)柠檬酸根离子与H⁺结合,减少H⁺在阴极放电;防止Fe²⁺被氧化为Fe³⁺(2分)
(4)3:1(1分) 加水充分浸取(1分),过滤(1分),向滤液中加入(NH₄)₂C₂O₄溶液,静置后向上层清液中继续滴加(NH₄)₂C₂O₄溶液,无浑浊(2分),过滤(1分)
处理废旧磁性合金钕铁硼回收钕与铁的实验
(1)①常温下,pH = 2.0时,c(H⁺) = 10⁻² mol · L⁻¹,K_a2(H₂SO₄) = $\frac{c(SO₃²⁻) · c(H⁺)}{c(HSO₄⁻)}$ = 10⁻².⁹,故$\frac{c(HSO₄⁻)}{c(SO₃²⁻)}$ = 1。②钕铁硼酸浸时消耗H⁺,c(H⁺)减小,随着反应温度升高,HSO₄⁻(aq) ⇌ H⁺(aq) + SO₄²⁻(aq)平衡逆向移动,抑制HSO₄⁻的电离,故溶液的pH迅速上升;降温后又促进HSO₄⁻的电离,故溶液的pH下降。
(2)①溶液中的Fe²⁺与过多的NaOH反应生成Fe(OH)₂,放置时间过长会与空气中的O₂产生FeOOH,故反应的离子方程式为4Fe²⁺ + O₂ + 8OH⁻ = 4FeOOH↓ + 2H₂O。②检验所得NaNd(SO₄)₂沉淀中是否含有铁元素时,可将沉淀中的铁元素转化为Fe³⁺,用KSCN溶液鉴别。
(3)过滤所得的滤液中含FeSO₄、H₂SO₄,电解时Fe²⁺、H⁺均能在阴极放电,为提高阴极的电解效率,需抑制H⁺放电,且防止Fe²⁺被氧化为Fe³⁺,故加入少量具有还原性的弱酸盐柠檬酸钠,既能防止Fe²⁺被氧化为Fe³⁺,且柠檬酸根离子(弱酸根离子)与H⁺结合,又能抑制H⁺在阴极放电。
(4)由题意知,该实验利用NdCl₃和(NH₄)₂C₂O₄之间的反应得到Nd₂(C₂O₄)₃,为了提高产品产率和纯度,需使Nd₂Fe₁₄B中的Nd元素完全转化为可溶于水的NdCl₃、使Fe元素完全转化为Fe₂O₃固体除去,则n(NH₄Cl):n(Nd₂Fe₁₄B) = 3:1时符合要求;将焙烧、冷却后的固体转移到烧杯中后,加水浸取,过滤除去Fe₂O₃,得到NdCl₃溶液,向NdCl₃溶液中加入(NH₄)₂C₂O₄溶液充分反应,得到Nd₂(C₂O₄)₃沉淀,为检验NdCl₃是否完全反应,可静置后向上层清液中滴加(NH₄)₂C₂O₄溶液,若无浑浊产生,则反应完全,过滤、洗涤、干燥即可获得Nd₂(C₂O₄)₃。
考情速递 数字赋能实验之结合X射线衍射设计实验方案 2025年新课程标准提出“数字赋能实验”,而实验题在高考化学试题中属于必考题型,常结合基础操作、现象研究、方案设计等多角度考查基础知识、反应原理,培养考生的实验探究能力。如2025年广东卷第17题设计实验方案测定HClO的K_a,江苏卷第16题要求补充实验方案比较含氯FeOOH在NaOH溶液与蒸馏水中浸泡的脱氯效果,本题结合X射线衍射图来选择n(NH₄Cl)和n(Nd₂Fe₁₄B)的最佳比例,进而补充以Nd₂Fe₁₄B为原料制备Nd₂(C₂O₄)₃的实验方案,考查形式创新,增强了实验探究的开放性,有利于提升考生解决实际问题的能力。
查看更多完整答案,请扫码查看


