2026年金考卷特快专递高中化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年金考卷特快专递高中化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
19. ☆(14分)${CO_{2}}$作为主要温室气体,其资源化利用对实现碳中和与环境保护具有重要意义。
(1)在${CO_{2}}$资源化利用过程中常使用含$Cu$催化剂,$Cu$的价层电子排布式为
(2)${CO_{2}}$和$CO$加氢制甲烷可实现${CO_{2}}$资源化利用的同时实现氢能的储存,相关反应如下:
Ⅰ. ${CO_{2}(g) + 4H_{2}(g)⇌ CH_{4}(g) + 2H_{2}O(g)}$ $\Delta H_{1} = -165\ kJ·mol^{-1}$
Ⅱ. ${CO(g) + 3H_{2}(g)⇌ CH_{4}(g) + H_{2}O(g)}$ $\Delta H_{2} = -206\ kJ·mol^{-1}$
①恒温下,向恒容密闭容器中充入一定量的${CO_{2}}$和${H_{2}}$,下列说法正确的是
A. 反应体系中涉及极性共价键和非极性共价键的断裂和生成
B. 容器中$n{(CH_{4})}$不变时,反应Ⅰ不一定达到平衡
C. $|\Delta H|$:Ⅱ > Ⅰ,由此可推断活化能:Ⅱ < Ⅰ
D. 待体系达到平衡时,增加$CO$的浓度,反应Ⅰ平衡逆向移动
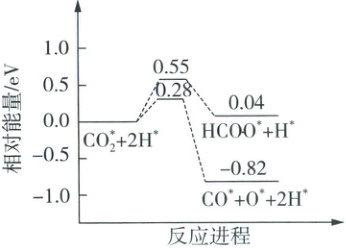
②${CO_{2}}$制备甲烷过程中,${CO_{2}}$活化的可能途径有两种,如图所示。请从反应速率和生成物稳定性角度分析说明${CO^{*}}$是${CO_{2}}$活化的优势含碳中间体的原因:
(3)${CO_{2}}$和${CH_{4}}$发生重整反应制备的${H_{2}/CO}$合成气可应用于多个有机合成反应,实现${CO_{2}}$的高值化利用,主要涉及的反应如下。
Ⅲ. ${CO_{2}(g) + CH_{4}(g)⇌ 2CO(g) + 2H_{2}(g)}$
Ⅳ. ${3CO_{2}(g) + CH_{4}(g)⇌ 4CO(g) + 2H_{2}O(g)}$ $\Delta H_{4} = +329\ kJ·mol^{-1}$
Ⅴ. ${CH_{4}(g)⇌ C(s) + 2H_{2}(g)}$ $\Delta H_{5} = +75\ kJ·mol^{-1}$
①基于反应Ⅰ、Ⅱ、Ⅳ,计算反应Ⅲ的$\Delta H_{3} =$
②反应温度对反应Ⅰ~Ⅴ的吉布斯自由能变$\Delta G$的影响如图所示,则曲线X对应的反应为

(4)恒容密闭容器中,初始投料$n_{0}{(CH_{4})}/n_{0}{(CO_{2})} = 1$的条件下,仅考虑反应Ⅲ~Ⅴ,达到化学平衡时,${CH_{4}}$和${CO_{2}}$的转化率及$n{(H_{2})}/n(CO)$随温度的变化趋势如图。

①综合反应Ⅲ~Ⅴ,解释当温度低于$850\ {^{\circ}C}$时,${CH_{4}}$的平衡转化率高于${CO_{2}}$的平衡转化率的原因:
②温度为$800\ {^{\circ}C}$,$n_{0}{(CH_{4})} = 1\ mol$,则平衡时的$n(CO) =$
(1)在${CO_{2}}$资源化利用过程中常使用含$Cu$催化剂,$Cu$的价层电子排布式为
3d¹⁰4s¹
。(2)${CO_{2}}$和$CO$加氢制甲烷可实现${CO_{2}}$资源化利用的同时实现氢能的储存,相关反应如下:
Ⅰ. ${CO_{2}(g) + 4H_{2}(g)⇌ CH_{4}(g) + 2H_{2}O(g)}$ $\Delta H_{1} = -165\ kJ·mol^{-1}$
Ⅱ. ${CO(g) + 3H_{2}(g)⇌ CH_{4}(g) + H_{2}O(g)}$ $\Delta H_{2} = -206\ kJ·mol^{-1}$
①恒温下,向恒容密闭容器中充入一定量的${CO_{2}}$和${H_{2}}$,下列说法正确的是
AD
。A. 反应体系中涉及极性共价键和非极性共价键的断裂和生成
B. 容器中$n{(CH_{4})}$不变时,反应Ⅰ不一定达到平衡
C. $|\Delta H|$:Ⅱ > Ⅰ,由此可推断活化能:Ⅱ < Ⅰ
D. 待体系达到平衡时,增加$CO$的浓度,反应Ⅰ平衡逆向移动
②${CO_{2}}$制备甲烷过程中,${CO_{2}}$活化的可能途径有两种,如图所示。请从反应速率和生成物稳定性角度分析说明${CO^{*}}$是${CO_{2}}$活化的优势含碳中间体的原因:
生成CO˙的路径活化能更小,因此反应速率快;CO˙能量比HCOO˙低,CO˙更稳定
。(3)${CO_{2}}$和${CH_{4}}$发生重整反应制备的${H_{2}/CO}$合成气可应用于多个有机合成反应,实现${CO_{2}}$的高值化利用,主要涉及的反应如下。
Ⅲ. ${CO_{2}(g) + CH_{4}(g)⇌ 2CO(g) + 2H_{2}(g)}$
Ⅳ. ${3CO_{2}(g) + CH_{4}(g)⇌ 4CO(g) + 2H_{2}O(g)}$ $\Delta H_{4} = +329\ kJ·mol^{-1}$
Ⅴ. ${CH_{4}(g)⇌ C(s) + 2H_{2}(g)}$ $\Delta H_{5} = +75\ kJ·mol^{-1}$
①基于反应Ⅰ、Ⅱ、Ⅳ,计算反应Ⅲ的$\Delta H_{3} =$
+247
$ kJ·mol^{-1}$。②反应温度对反应Ⅰ~Ⅴ的吉布斯自由能变$\Delta G$的影响如图所示,则曲线X对应的反应为
V
(填序号)。欲使反应Ⅲ自发进行,反应体系的温度应高于
(填“高于”或“低于”)$642\ {^{\circ}C}$。
(4)恒容密闭容器中,初始投料$n_{0}{(CH_{4})}/n_{0}{(CO_{2})} = 1$的条件下,仅考虑反应Ⅲ~Ⅴ,达到化学平衡时,${CH_{4}}$和${CO_{2}}$的转化率及$n{(H_{2})}/n(CO)$随温度的变化趋势如图。


①综合反应Ⅲ~Ⅴ,解释当温度低于$850\ {^{\circ}C}$时,${CH_{4}}$的平衡转化率高于${CO_{2}}$的平衡转化率的原因:
综合分析,在温度小于850℃时,反应V对CH₄的转化率提高的效果胜于反应IV对CO₂转化率提高的效果
。②温度为$800\ {^{\circ}C}$,$n_{0}{(CH_{4})} = 1\ mol$,则平衡时的$n(CO) =$
$\frac{2b-2a}{m-1}$
。(用含$a$、$b$、$m$的表达式表示)
答案:
19.
(1)3d¹⁰4s¹(2分)
(2)①AD(2分) ②生成CO˙的路径活化能更小,因此反应速率快;CO˙能量比HCOO˙低,CO˙更稳定(2分)
(3)①+247(2分) ②V(1分) 高于(1分)
(4)①综合分析,在温度小于850℃时,反应V对CH₄的转化率提高的效果胜于反应IV对CO₂转化率提高的效果(2分)
②$\frac{2b−2a}{m−1}$(2分)
价电子排布式、化学平衡、反应热的计算、平衡转化率等
(1)Cu是29号元素,Cu的价层电子排布式为3d¹⁰4s¹。
(2)①反应I和反应II均为可逆反应,故反应体系中既存在CH₄、CO₂、H₂O中极性共价键的断裂与生成,也存在H₂中非极性共价键的断裂和生成,A正确;反应I和反应II都有甲烷生成,当容器中n(CH₄)不再变化时,反应I和反应II都已经达到平衡状态,B错误;活化能的大小与|△H|的大小无关,不能推断反应I、II活化能的大小,C错误;待体系达到平衡时,增加CO的浓度,反应II平衡正向移动,CH₄和H₂O的浓度均增大,导致反应I平衡逆向移动,D正确。 ②根据题图可知,生成CO˙中间体的路径活化能较小,因此反应速率更快,且CO˙中间体的能量比HCOO˙中间体的能量低,CO˙中间体更稳定,因此CO˙是CO₂活化的优势含碳中间体
(3)①根据盖斯定律可得,反应III=反应I−反应II×2,则反应III的△H=△H₁−2△H₂=−165kJ·mol⁻¹−2×(−206kJ·mol⁻¹)=+247kJ·mol⁻¹(另解:或通过反应III=(反应V−反应I)÷2=(反应IV−反应II×2)÷3计算)。②根据题图可知,曲线X对应的反应在高温下自发进行(△G<0),因此该反应为吸热反应,结合反应I的△H₁<0,为放热反应,故排除反应I,随温度升高,△G减小的三条曲线中,曲线X在纵轴的截距更小,结合△G=△H−T△S知,该反应对应的△H更小,故曲线X代表反应V。△G<0时反应能自发进行,故欲使反应III自发进行,反应体系的温度应高于642℃。
(4)①进行反应III时,CH₄的转化率和CO₂的转化率相等,进行反应IV时有利于增大CO₂的平衡转化率,进行反应V时仅能增大CH₄的平衡转化率,温度低于850℃时,CH₄的平衡转化率高于CO₂的平衡转化率,说明反应V对CH₄的转化率提高的效果胜于反应IV对CO₂转化率提高的效果。 ②解法一:n(CH₄)=n(CO₂)=1mol,根据题图可知,800℃反应达到平衡时,剩余CH₄的物质的量为(1−b)mol,剩余CO₂的物质的量为(1−a)mol,设平衡时n(CO)=xmol,则根据氧原子守恒,n(H₂O)=[2−2(1−a)−x]mol=(2a−x)mol,根据氢原子守恒,n(H₂)=$\frac{4−4(1−b)−2(2a−x)}{2}$mol=[2(b−a)+x]mol,此时$\frac{n(H₂)}{n(CO)}$=m,即$\frac{2(b−a)+x}{x}$=m,解得x=$\frac{2b−2a}{m−1}$,因此平衡时n(CO)=$\frac{2b−2a}{m−1}$mol。解法二:n(CH₄)=n(CO₂)=1mol,800℃反应达到平衡时,甲烷转化bmol,二氧化碳转化amol,设CH₄在反应III、IV、V中的转化量分别为xmol、ymol、zmol,列关系式可得:
反应III CO₂(g)+CH₄(g)$\rightleftharpoons$2CO(g)+2H₂(g)
转化量/mol x x 2x 2x
反应IV 3CO₂(g)+CH₄(g)$\rightleftharpoons$4CO(g)+2H₂O(g)
转化量/mol 3y y 4y 2y
反应V CH₄(g)$\rightleftharpoons$C(s)+2H₂(g)
转化量/mol z 2z
可得x+3y=a①,x+y+z=b②,$\frac{2x+2z}{2x+4y}$=m③,联立等式①②③可得,y=$\frac{am−b}{m−1}$,平衡时n(CO)=(2x+4y)mol=(2a−2y)mol=$\frac{2b−2a}{m−1}$mol。
考情速递2025课标新变化:关注化学与环境保护,促进化学与社会发展 高考题中常涉及对一氧化碳、二氧化碳、甲烷等气体的资源化利用,实现碳中和与环境保护,跟2025年修订的课标中新增的碳达峰碳中和内容相符。如2025年河南卷第17题结合CaCO₃的热分解与Ni₃P催化的CH₄重整生产高纯度合成气,实现碳资源的二次利用,考查物质结构与性质、晶胞分析与计算、化学平衡等知识,江苏卷第10题以电催化CO₂与NO₃⁻生成CO(NH₂)₂的反应机理图为载体考查,本题通过CO₂和CO加氢制甲烷、CO₂和甲烷重整制合成气来实现二氧化碳的资源化利用,考查化学平衡、反应热的计算、平衡转化率等,联系实际生产应用,利用所学化学知识解决实际问题,保护生态环境,实现双碳目标。
(1)3d¹⁰4s¹(2分)
(2)①AD(2分) ②生成CO˙的路径活化能更小,因此反应速率快;CO˙能量比HCOO˙低,CO˙更稳定(2分)
(3)①+247(2分) ②V(1分) 高于(1分)
(4)①综合分析,在温度小于850℃时,反应V对CH₄的转化率提高的效果胜于反应IV对CO₂转化率提高的效果(2分)
②$\frac{2b−2a}{m−1}$(2分)
价电子排布式、化学平衡、反应热的计算、平衡转化率等
(1)Cu是29号元素,Cu的价层电子排布式为3d¹⁰4s¹。
(2)①反应I和反应II均为可逆反应,故反应体系中既存在CH₄、CO₂、H₂O中极性共价键的断裂与生成,也存在H₂中非极性共价键的断裂和生成,A正确;反应I和反应II都有甲烷生成,当容器中n(CH₄)不再变化时,反应I和反应II都已经达到平衡状态,B错误;活化能的大小与|△H|的大小无关,不能推断反应I、II活化能的大小,C错误;待体系达到平衡时,增加CO的浓度,反应II平衡正向移动,CH₄和H₂O的浓度均增大,导致反应I平衡逆向移动,D正确。 ②根据题图可知,生成CO˙中间体的路径活化能较小,因此反应速率更快,且CO˙中间体的能量比HCOO˙中间体的能量低,CO˙中间体更稳定,因此CO˙是CO₂活化的优势含碳中间体
(3)①根据盖斯定律可得,反应III=反应I−反应II×2,则反应III的△H=△H₁−2△H₂=−165kJ·mol⁻¹−2×(−206kJ·mol⁻¹)=+247kJ·mol⁻¹(另解:或通过反应III=(反应V−反应I)÷2=(反应IV−反应II×2)÷3计算)。②根据题图可知,曲线X对应的反应在高温下自发进行(△G<0),因此该反应为吸热反应,结合反应I的△H₁<0,为放热反应,故排除反应I,随温度升高,△G减小的三条曲线中,曲线X在纵轴的截距更小,结合△G=△H−T△S知,该反应对应的△H更小,故曲线X代表反应V。△G<0时反应能自发进行,故欲使反应III自发进行,反应体系的温度应高于642℃。
(4)①进行反应III时,CH₄的转化率和CO₂的转化率相等,进行反应IV时有利于增大CO₂的平衡转化率,进行反应V时仅能增大CH₄的平衡转化率,温度低于850℃时,CH₄的平衡转化率高于CO₂的平衡转化率,说明反应V对CH₄的转化率提高的效果胜于反应IV对CO₂转化率提高的效果。 ②解法一:n(CH₄)=n(CO₂)=1mol,根据题图可知,800℃反应达到平衡时,剩余CH₄的物质的量为(1−b)mol,剩余CO₂的物质的量为(1−a)mol,设平衡时n(CO)=xmol,则根据氧原子守恒,n(H₂O)=[2−2(1−a)−x]mol=(2a−x)mol,根据氢原子守恒,n(H₂)=$\frac{4−4(1−b)−2(2a−x)}{2}$mol=[2(b−a)+x]mol,此时$\frac{n(H₂)}{n(CO)}$=m,即$\frac{2(b−a)+x}{x}$=m,解得x=$\frac{2b−2a}{m−1}$,因此平衡时n(CO)=$\frac{2b−2a}{m−1}$mol。解法二:n(CH₄)=n(CO₂)=1mol,800℃反应达到平衡时,甲烷转化bmol,二氧化碳转化amol,设CH₄在反应III、IV、V中的转化量分别为xmol、ymol、zmol,列关系式可得:
反应III CO₂(g)+CH₄(g)$\rightleftharpoons$2CO(g)+2H₂(g)
转化量/mol x x 2x 2x
反应IV 3CO₂(g)+CH₄(g)$\rightleftharpoons$4CO(g)+2H₂O(g)
转化量/mol 3y y 4y 2y
反应V CH₄(g)$\rightleftharpoons$C(s)+2H₂(g)
转化量/mol z 2z
可得x+3y=a①,x+y+z=b②,$\frac{2x+2z}{2x+4y}$=m③,联立等式①②③可得,y=$\frac{am−b}{m−1}$,平衡时n(CO)=(2x+4y)mol=(2a−2y)mol=$\frac{2b−2a}{m−1}$mol。
考情速递2025课标新变化:关注化学与环境保护,促进化学与社会发展 高考题中常涉及对一氧化碳、二氧化碳、甲烷等气体的资源化利用,实现碳中和与环境保护,跟2025年修订的课标中新增的碳达峰碳中和内容相符。如2025年河南卷第17题结合CaCO₃的热分解与Ni₃P催化的CH₄重整生产高纯度合成气,实现碳资源的二次利用,考查物质结构与性质、晶胞分析与计算、化学平衡等知识,江苏卷第10题以电催化CO₂与NO₃⁻生成CO(NH₂)₂的反应机理图为载体考查,本题通过CO₂和CO加氢制甲烷、CO₂和甲烷重整制合成气来实现二氧化碳的资源化利用,考查化学平衡、反应热的计算、平衡转化率等,联系实际生产应用,利用所学化学知识解决实际问题,保护生态环境,实现双碳目标。
查看更多完整答案,请扫码查看


