2026年金考卷特快专递高中化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年金考卷特快专递高中化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
5. 化学与生产、生活密切相关。下列现象或事实的对应解释错误的是
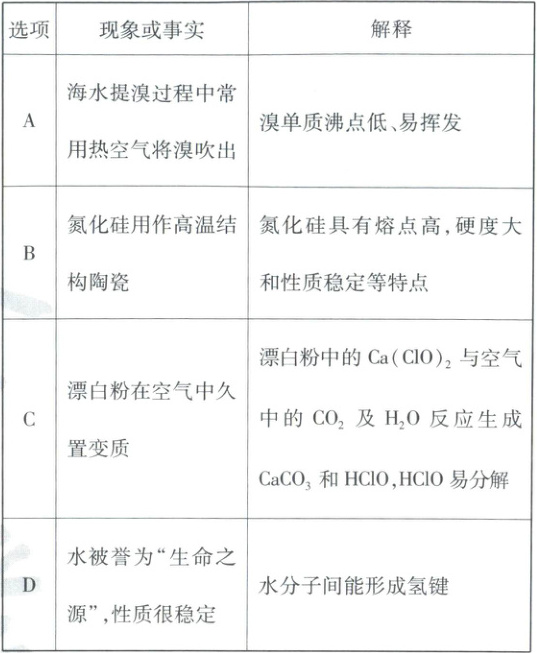

答案:
5.D 化学与CSTSE 水分子中O一H键键长较短、键能大,故H2O稳定性高,而水分子间形成的氢键使水沸点升高,与其稳定性无关,D项错误。
溴单质沸点低、易挥发,故海水提溴过程中常用热空气将溴吹出,A项正确;氮化硅为共价晶体,具有熔点高、硬度大和性质
稳定等特点,可用作高温结构陶瓷,B项正确;漂白粉的有效成分为Ca(ClO)2,可与空气中的CO2及水蒸气发生反应:
Ca(ClO)2+CO2+H2O=CaCO↓+2HCIO,生成的次氯酸见光易分解;2HC10≌光照2HCI+O2↑,因此漂白粉在空气中久置变质,C项正确
溴单质沸点低、易挥发,故海水提溴过程中常用热空气将溴吹出,A项正确;氮化硅为共价晶体,具有熔点高、硬度大和性质
稳定等特点,可用作高温结构陶瓷,B项正确;漂白粉的有效成分为Ca(ClO)2,可与空气中的CO2及水蒸气发生反应:
Ca(ClO)2+CO2+H2O=CaCO↓+2HCIO,生成的次氯酸见光易分解;2HC10≌光照2HCI+O2↑,因此漂白粉在空气中久置变质,C项正确
6. 雌黄(${As_{2}S_{3}}$)和雄黄(${As_{4}S_{4}}$)都是自然界中常见的难溶砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也可用来入药。一定条件下,雌黄和雄黄的转化关系如图所示(雌黄和雄黄中$S$元素的价态相同)。下列说法正确的是
(图:反应Ⅰ:${As_{2}S_{3} + H^{+} + Sn^{2+} -> As_{4}S_{4} + H_{2}S + Sn^{4+}}$;反应Ⅱ:${As_{4}S_{4} + O_{2} -> As_{2}O_{3} + 物质a}$;反应Ⅲ:${As_{2}O_{3} + H_{2}O -> H_{3}AsO_{3}}$;反应Ⅳ:${H_{3}AsO_{3} + H_{2}S -> As_{2}S_{3} + H_{2}O}$)

A.反应过程中的尾气用浓硝酸吸收
B.反应Ⅱ中若物质$a$为${SO_{2}}$,当${2.14\ g\ As_{4}S_{4}}$参与反应时转移$0.12\ mol\ {e^{-}}$
C.反应Ⅰ的离子方程式为${4H^{+} + 2Sn^{2+} + 2As_{2}S_{3} = 2Sn^{4+} + As_{4}S_{4} + 2H_{2}S\uparrow}$
D.反应Ⅰ、Ⅱ、Ⅲ、Ⅳ均为非氧化还原反应
(图:反应Ⅰ:${As_{2}S_{3} + H^{+} + Sn^{2+} -> As_{4}S_{4} + H_{2}S + Sn^{4+}}$;反应Ⅱ:${As_{4}S_{4} + O_{2} -> As_{2}O_{3} + 物质a}$;反应Ⅲ:${As_{2}O_{3} + H_{2}O -> H_{3}AsO_{3}}$;反应Ⅳ:${H_{3}AsO_{3} + H_{2}S -> As_{2}S_{3} + H_{2}O}$)

A.反应过程中的尾气用浓硝酸吸收
B.反应Ⅱ中若物质$a$为${SO_{2}}$,当${2.14\ g\ As_{4}S_{4}}$参与反应时转移$0.12\ mol\ {e^{-}}$
C.反应Ⅰ的离子方程式为${4H^{+} + 2Sn^{2+} + 2As_{2}S_{3} = 2Sn^{4+} + As_{4}S_{4} + 2H_{2}S\uparrow}$
D.反应Ⅰ、Ⅱ、Ⅲ、Ⅳ均为非氧化还原反应
答案:
6.C 离子反应、氧化还原反应 根据题图可知,反应I的反应物为H、Sn²+、AsS3,生成物为H2S、Sn4°、As4S4,根据氧化还原反应规律可得反应的离子方程式为4H”+2Sn²++2As2S3=2Sn4++As4S4+2H2S↑,C项正确。
错误项分析 根据转化关系图及原子守恒知,反应II中生成的物质a为SO2,SO2具有还原性,与浓硝酸(具有强氧化性)反应可生成有毒的氮氧化物,造成二次污染,A项错误;反应II中
As4S4转化为As203、SO2,As由+2价升高为+3价,S由−2价升高为+4价,1m(olAs4S4参与反应失28mol电子,故2.14g (0.005mol)As4S4参与反应,转移0.14mole,B项错误;反应I中Sn、As的化合价发生变化,反应II中As、S、O的化合价发生变化,反应I、II为氧化还原反应,反应III、IV中没有元素化合价发生变化,为非氧化还原反应,D项错误
错误项分析 根据转化关系图及原子守恒知,反应II中生成的物质a为SO2,SO2具有还原性,与浓硝酸(具有强氧化性)反应可生成有毒的氮氧化物,造成二次污染,A项错误;反应II中
As4S4转化为As203、SO2,As由+2价升高为+3价,S由−2价升高为+4价,1m(olAs4S4参与反应失28mol电子,故2.14g (0.005mol)As4S4参与反应,转移0.14mole,B项错误;反应I中Sn、As的化合价发生变化,反应II中As、S、O的化合价发生变化,反应I、II为氧化还原反应,反应III、IV中没有元素化合价发生变化,为非氧化还原反应,D项错误
7. 下列能正确表示反应的离子方程式的是
A.将二氧化硫通入硝酸钡溶液中,产生白色沉淀:${SO_{2} + Ba^{2+} + H_{2}O = BaSO_{3}\downarrow + 2H^{+}}$
B.${CuSO_{4}}$溶液中通入$HCl$,溶液变为黄绿色:${[Cu(H_{2}O)_{4}]^{2+} + 4Cl^{-}⇌ [CuCl_{4}]^{2-} + 4H_{2}O}$
C.少量${Ca(OH)_{2}}$溶液与过量${NaHCO_{3}}$溶液反应:${HCO^{-}_{3} + Ca^{2+} + OH^{-} = CaCO_{3}\downarrow + H_{2}O}$
D.甲醛溶液中加入足量的银氨溶液并加热:${HCHO + 2[Ag(NH_{3})_{2}]^{+} + 2OH^{-}\xrightarrow{\Delta} HCOO^{-} + NH^{+}_{4} + 2Ag\downarrow + 3NH_{3} + H_{2}O}$
A.将二氧化硫通入硝酸钡溶液中,产生白色沉淀:${SO_{2} + Ba^{2+} + H_{2}O = BaSO_{3}\downarrow + 2H^{+}}$
B.${CuSO_{4}}$溶液中通入$HCl$,溶液变为黄绿色:${[Cu(H_{2}O)_{4}]^{2+} + 4Cl^{-}⇌ [CuCl_{4}]^{2-} + 4H_{2}O}$
C.少量${Ca(OH)_{2}}$溶液与过量${NaHCO_{3}}$溶液反应:${HCO^{-}_{3} + Ca^{2+} + OH^{-} = CaCO_{3}\downarrow + H_{2}O}$
D.甲醛溶液中加入足量的银氨溶液并加热:${HCHO + 2[Ag(NH_{3})_{2}]^{+} + 2OH^{-}\xrightarrow{\Delta} HCOO^{-} + NH^{+}_{4} + 2Ag\downarrow + 3NH_{3} + H_{2}O}$
答案:
7.B 离子方程式的正误判断 CuSO溶液中通人HCI,溶液变为黄绿色,即蓝色的[Cu(HO).]²+转化为绿色的[CuCl4]²
B项正确
错误项分析 将二氧化硫通入硝酸钡溶液中,发生氧化还原反应(SO2溶于水生成HSO,酸性条件下NO具有强氧化性):3SO+3Ba²++2NO+2HO=3BaSO↓+2NO↑+4H,A 项错误;少量Ca(OH)2溶液与过量NaHCO3溶液反应,按照“以少定多”原则,Ca²+与0H 的化学计量数之比为1;2;
Ca²++2OH +2HCO=CaCO↓+CO²| +2H2O,C项错误;甲醛溶液中加入足量的银氨溶液并加热:HCHO+4[Ag(NH)2]+4OH 一△2NH4++CO² +4Ag↓+6NH+2HO,D项错误
B项正确
错误项分析 将二氧化硫通入硝酸钡溶液中,发生氧化还原反应(SO2溶于水生成HSO,酸性条件下NO具有强氧化性):3SO+3Ba²++2NO+2HO=3BaSO↓+2NO↑+4H,A 项错误;少量Ca(OH)2溶液与过量NaHCO3溶液反应,按照“以少定多”原则,Ca²+与0H 的化学计量数之比为1;2;
Ca²++2OH +2HCO=CaCO↓+CO²| +2H2O,C项错误;甲醛溶液中加入足量的银氨溶液并加热:HCHO+4[Ag(NH)2]+4OH 一△2NH4++CO² +4Ag↓+6NH+2HO,D项错误
8. 下列实验装置或操作能达到实验目的的是


答案:
8.D 化学实验装置分析和评价 在干燥的HCI气流中加热MgCl.6H2O,可以抑制MgCl的水解,得到无水MgCl,干燥管中无水CaClL可吸收反应生成的H2O,同时防止空气中的水蒸气进入硬质玻璃管中,D项能达到实验目的
盐酸为挥发性酸,故碳酸钠和稀盐酸反应生成的CO2中含有挥发出的HCl,二者均能与Na2SiO反应生成HSiO沉淀,无法比较H2CO和H2SiO的酸性强弱,且HCI不是CI的最高价含氧酸,无法比较CI、C、Si的非金属性,A项不能达到实验目的;苯和液溴在Fe/FeBr;催化条件下发生取代反应生成溴苯,苯和浓溴水不反应,会萃取浓溴水中的溴,B项不能达到实验目的;NHCI受热分解生成的NH3和HCI在试管口冷却后会重新生成NHCI固体,不能用于制取NH,C项不能达到实验目的
盐酸为挥发性酸,故碳酸钠和稀盐酸反应生成的CO2中含有挥发出的HCl,二者均能与Na2SiO反应生成HSiO沉淀,无法比较H2CO和H2SiO的酸性强弱,且HCI不是CI的最高价含氧酸,无法比较CI、C、Si的非金属性,A项不能达到实验目的;苯和液溴在Fe/FeBr;催化条件下发生取代反应生成溴苯,苯和浓溴水不反应,会萃取浓溴水中的溴,B项不能达到实验目的;NHCI受热分解生成的NH3和HCI在试管口冷却后会重新生成NHCI固体,不能用于制取NH,C项不能达到实验目的
查看更多完整答案,请扫码查看


