2026年金考卷特快专递高中化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年金考卷特快专递高中化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
11. ☆某研究小组设计如图所示装置,验证${SO_{2}}$性质,下列说法正确的是
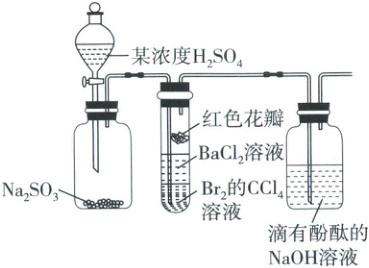
A.实验室用98%的浓硫酸和亚硫酸钠固体制备${SO_{2}}$
B.试管中的红色花瓣褪色,说明${SO_{2}}$具有漂白性
C.一段时间后试管内有白色沉淀,说明有${BaSO_{3}}$生成
D.试管内${Br_{2}}$的${CCl_{4}}$溶液褪色,说明${SO_{2}}$具有氧化性

A.实验室用98%的浓硫酸和亚硫酸钠固体制备${SO_{2}}$
B.试管中的红色花瓣褪色,说明${SO_{2}}$具有漂白性
C.一段时间后试管内有白色沉淀,说明有${BaSO_{3}}$生成
D.试管内${Br_{2}}$的${CCl_{4}}$溶液褪色,说明${SO_{2}}$具有氧化性
答案:
11.B SO₂的制备及性质探究 SO₂具有漂白性,能与某些有色物质结合生成不稳定的无色物质,导致花瓣褪色,B正确。
错误项分析 98%的浓硫酸中,硫酸主要以分子形式存在,H⁺浓度低,反应速率慢,故实验室制备SO₂时,通常使用70%左右的硫酸,A错误;根据“强酸制弱酸”知,SO₂与BaCl₂溶液反应不能生成BaSO₃,试管中SO₂被Br₂氧化生成SO₄²⁻,SO₄²⁻与Ba²⁺结合生成白色BaSO₄沉淀,C错误;SO₂与Br₂发生氧化还原反应:SO₂+Br₂+2H₂O=H₂SO₄+2HBr,Br₂的CCl₄溶液褪色,SO₂体现还原性,D错误。
易错警示 SO₂的制备在模拟题中比较常见,但是部分考生并没有对其中细节进行深究。本题A项表面看来是对实验试剂选择的考查,但实际需要考生转换思维,从结构的角度考虑,硫酸属于共价化合物,在水溶液中能够电离
考情速递创新实验探究考查形式一微型实验 新课标强调实践应用,通过化学原理与实验分析方法解决实际问题,展示科学思维过程与水平,化学实验是高考题中必考的内容,试题注重对实验操作、实验方案等的考查,如2025年黑吉辽内蒙古卷第12题结合测定含Cl⁻水样的化学需氧量的实验考查,广东卷第11题联系实验装置考查实验操作与实验现象分析。本题设计实验探究二氧化硫的性质,考查实验试剂的选择、实验现象的分析等,均在选择题中进行考查,实验原理和实验仪器均较为常见,考查考生的迁移应用能力和实验探究能力,突出实践与思维的双重考查。
错误项分析 98%的浓硫酸中,硫酸主要以分子形式存在,H⁺浓度低,反应速率慢,故实验室制备SO₂时,通常使用70%左右的硫酸,A错误;根据“强酸制弱酸”知,SO₂与BaCl₂溶液反应不能生成BaSO₃,试管中SO₂被Br₂氧化生成SO₄²⁻,SO₄²⁻与Ba²⁺结合生成白色BaSO₄沉淀,C错误;SO₂与Br₂发生氧化还原反应:SO₂+Br₂+2H₂O=H₂SO₄+2HBr,Br₂的CCl₄溶液褪色,SO₂体现还原性,D错误。
易错警示 SO₂的制备在模拟题中比较常见,但是部分考生并没有对其中细节进行深究。本题A项表面看来是对实验试剂选择的考查,但实际需要考生转换思维,从结构的角度考虑,硫酸属于共价化合物,在水溶液中能够电离
考情速递创新实验探究考查形式一微型实验 新课标强调实践应用,通过化学原理与实验分析方法解决实际问题,展示科学思维过程与水平,化学实验是高考题中必考的内容,试题注重对实验操作、实验方案等的考查,如2025年黑吉辽内蒙古卷第12题结合测定含Cl⁻水样的化学需氧量的实验考查,广东卷第11题联系实验装置考查实验操作与实验现象分析。本题设计实验探究二氧化硫的性质,考查实验试剂的选择、实验现象的分析等,均在选择题中进行考查,实验原理和实验仪器均较为常见,考查考生的迁移应用能力和实验探究能力,突出实践与思维的双重考查。
12. $LiDFOB$是一种新型电池中的电解质锂盐,结构如图所示。其中M、X、Y、Z为原子序数依次增大的同一短周期元素,X原子核外的s轨道与p轨道上的电子数之比为2:1,下列叙述正确的是
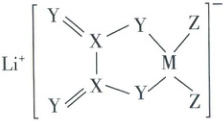
A.原子半径:M < Y < Z
B.键角:${XZ_{4}} < {YZ_{2}}$
C.第一电离能:Z > Y > X
D.最简单氢化物沸点:Z > Y > X

A.原子半径:M < Y < Z
B.键角:${XZ_{4}} < {YZ_{2}}$
C.第一电离能:Z > Y > X
D.最简单氢化物沸点:Z > Y > X
答案:
12.C 元素推断、元素周期律、物质结构
审元素根据X原子核外的s轨道与p轨道上的电子数之比为2:1,且X为短周期元素知,X原子的核外电子排布式为1s²2s²2p²,则X为C;由题给结构图可知,阴离子带1个单位负电荷,M形成4个键、Y形成2个键、Z形成1个键,根据M、X、Y、Z为原子序数依次增大的同一短周期元素知,Y、Z分别为O、F,M为B。
同周期主族元素从左到右,第一电离能整体呈增大的趋势,故第一电离能:F>O>C,C正确。
错误项分析 同周期主族元素从左到右,原子半径逐渐减小,故原子半径:B>O>F,A错误;CF₄中C原子价层电子对数为4+$\frac{4−1×4}{2}$=4,无孤电子对,键角为109°28′,OF₂中O原子价层电子对数为2+$\frac{6−2×1}{2}$=4,有2个孤电子对,孤电子对间的斥力大于成键电子对对成键电子对的斥力,故OF₂的键角小于109°28′,即键角:CF₄>OF₂,B错误;H₂O、HF均可形成分子间氢键,故沸点较高,且常温下H₂O为液态,HF为气态,故H₂O沸点更高,CH₄分子间无氢键,只存在范德华力,沸点较低,故沸点:H₂O>HF>CH₄,D错误
审元素根据X原子核外的s轨道与p轨道上的电子数之比为2:1,且X为短周期元素知,X原子的核外电子排布式为1s²2s²2p²,则X为C;由题给结构图可知,阴离子带1个单位负电荷,M形成4个键、Y形成2个键、Z形成1个键,根据M、X、Y、Z为原子序数依次增大的同一短周期元素知,Y、Z分别为O、F,M为B。
同周期主族元素从左到右,第一电离能整体呈增大的趋势,故第一电离能:F>O>C,C正确。
错误项分析 同周期主族元素从左到右,原子半径逐渐减小,故原子半径:B>O>F,A错误;CF₄中C原子价层电子对数为4+$\frac{4−1×4}{2}$=4,无孤电子对,键角为109°28′,OF₂中O原子价层电子对数为2+$\frac{6−2×1}{2}$=4,有2个孤电子对,孤电子对间的斥力大于成键电子对对成键电子对的斥力,故OF₂的键角小于109°28′,即键角:CF₄>OF₂,B错误;H₂O、HF均可形成分子间氢键,故沸点较高,且常温下H₂O为液态,HF为气态,故H₂O沸点更高,CH₄分子间无氢键,只存在范德华力,沸点较低,故沸点:H₂O>HF>CH₄,D错误
13. 下列陈述Ⅰ和陈述Ⅱ均正确,且具有因果关系的是


答案:
13.B 物质结构与性质 牙齿表面主要成分为羟基磷灰石[Ca₅(PO₄)₃OH],将其转化为氟磷灰石[Ca₅(PO₄)₃F]反应的K>1,说明该反应正向进行程度较大,且氟磷灰石更耐酸侵蚀,故添加氟化物可使牙齿表面的羟基磷灰石转化为更稳定的氟磷灰石,从而预防龋齿,B符合题意。
Al(OH)₃用于治疗胃酸是因为其能与胃酸(HCl)发生中和反应:Al(OH)₃+3HCl=AlCl₃+3H₂O,与其难溶于水无关,A不符合题意;聚乳酸由乳酸( )发生缩聚反应生成,陈述II错误,C不符合题意;合成氨的反应中,铁触媒作催化剂,不影响平衡产率,D不符合题意。
)发生缩聚反应生成,陈述II错误,C不符合题意;合成氨的反应中,铁触媒作催化剂,不影响平衡产率,D不符合题意。
回归教材B项源自人教版选择性必修1P85[科学.技术.社会 氟化物预防龋齿的化学原理]。
13.B 物质结构与性质 牙齿表面主要成分为羟基磷灰石[Ca₅(PO₄)₃OH],将其转化为氟磷灰石[Ca₅(PO₄)₃F]反应的K>1,说明该反应正向进行程度较大,且氟磷灰石更耐酸侵蚀,故添加氟化物可使牙齿表面的羟基磷灰石转化为更稳定的氟磷灰石,从而预防龋齿,B符合题意。
Al(OH)₃用于治疗胃酸是因为其能与胃酸(HCl)发生中和反应:Al(OH)₃+3HCl=AlCl₃+3H₂O,与其难溶于水无关,A不符合题意;聚乳酸由乳酸(
 )发生缩聚反应生成,陈述II错误,C不符合题意;合成氨的反应中,铁触媒作催化剂,不影响平衡产率,D不符合题意。
)发生缩聚反应生成,陈述II错误,C不符合题意;合成氨的反应中,铁触媒作催化剂,不影响平衡产率,D不符合题意。回归教材B项源自人教版选择性必修1P85[科学.技术.社会 氟化物预防龋齿的化学原理]。
14. 部分铁、铜物质的“价—类”关系如图所示,下列叙述错误的是

A.可能实现d→b→a转化
B.e、f均可由化合反应制得
C.e可用于治疗和预防缺铁性贫血
D.向沸水中滴加饱和e溶液,继续煮沸至液体呈红褐色,即制得g胶体

A.可能实现d→b→a转化
B.e、f均可由化合反应制得
C.e可用于治疗和预防缺铁性贫血
D.向沸水中滴加饱和e溶液,继续煮沸至液体呈红褐色,即制得g胶体
答案:
14.C 铁、铜及其化合物的性质与转化 由图可知,e为铁盐,而合成血红蛋白的血红素为Fe²⁺的配合物,治疗缺铁性贫血应使用亚铁盐,C错误。
若d为Cu(OH)₂,b为Cu₂O,a为Cu,新制Cu(OH)₂悬浊液与甲醛反应,可生成Cu₂O,Cu₂O可被氢气还原为Cu单质,A正确;若e为FeCl₃,可由化合反应2Fe+3Cl₂$\xlongequal{\triangle}$2FeCl₃制得,若f为FeCl₂,则可由化合反应2FeCl₃+Fe=3FeCl₂制得,若f为CuCl₂,则可由化合反应Cu+Cl₂$\xlongequal{\triangle}$CuCl₂制得,B正确;向沸水中滴加饱和铁盐(如FeCl₃)溶液,煮沸至液体呈红褐色即可得到Fe(OH)₃胶体,D正确。
若d为Cu(OH)₂,b为Cu₂O,a为Cu,新制Cu(OH)₂悬浊液与甲醛反应,可生成Cu₂O,Cu₂O可被氢气还原为Cu单质,A正确;若e为FeCl₃,可由化合反应2Fe+3Cl₂$\xlongequal{\triangle}$2FeCl₃制得,若f为FeCl₂,则可由化合反应2FeCl₃+Fe=3FeCl₂制得,若f为CuCl₂,则可由化合反应Cu+Cl₂$\xlongequal{\triangle}$CuCl₂制得,B正确;向沸水中滴加饱和铁盐(如FeCl₃)溶液,煮沸至液体呈红褐色即可得到Fe(OH)₃胶体,D正确。
查看更多完整答案,请扫码查看


