2026年新高考5年真题高中化学全一册通用版湖南专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题高中化学全一册通用版湖南专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第18页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
5. 下列有关电极方程式或离子方程式错误的是 (
A.碱性锌锰电池的正极反应:$MnO_2 + H_2O + e^- \xlongequal{} MnO(OH) + OH^-$
B.铅酸蓄电池充电时的阳极反应:$Pb^{2+} + 2H_2O - 2e^- \xlongequal{} PbO_2 + 4H^+$
C.$K_3[Fe(CN)_6]$ 溶液滴入 $FeCl_2$ 溶液中:$K^+ + Fe^{2+} + [Fe(CN)_6]^{3-} \xlongequal{} KFe[Fe(CN)_6] \downarrow$
D.$TiCl_4$ 加入水中:$TiCl_4 + (x + 2)H_2O \xlongequal{} TiO_2 · xH_2O \downarrow + 4H^+ + 4Cl^-$
B
)A.碱性锌锰电池的正极反应:$MnO_2 + H_2O + e^- \xlongequal{} MnO(OH) + OH^-$
B.铅酸蓄电池充电时的阳极反应:$Pb^{2+} + 2H_2O - 2e^- \xlongequal{} PbO_2 + 4H^+$
C.$K_3[Fe(CN)_6]$ 溶液滴入 $FeCl_2$ 溶液中:$K^+ + Fe^{2+} + [Fe(CN)_6]^{3-} \xlongequal{} KFe[Fe(CN)_6] \downarrow$
D.$TiCl_4$ 加入水中:$TiCl_4 + (x + 2)H_2O \xlongequal{} TiO_2 · xH_2O \downarrow + 4H^+ + 4Cl^-$
答案:
5. 参考答案 B
命题意图:本题考查电极反应、离子方程式的书写,通过电极反应或离子方程式解释相应的反应原理,体现了“宏观辨识与微观探析”化学学科核心素养。
解题思路:碱性锌锰电池中正极上MnO₂得电子生成MnO(OH),A项正确。铅酸蓄电池充电时,阳极上PbSO₄失电子生成PbO₂,电极反应为PbSO₄ - 2e⁻ + 2H₂O ══ PbO₂ + 4H⁺ + SO₄²⁻,B项错误。K₃[Fe(CN)₆]溶液滴入FeCl₂溶液中,产生KFe[Fe(CN)₆]蓝色沉淀,C项正确。TiCl₄加入水中发生水解反应生成TiO₂·xH₂O和HCl,D项正确。
命题意图:本题考查电极反应、离子方程式的书写,通过电极反应或离子方程式解释相应的反应原理,体现了“宏观辨识与微观探析”化学学科核心素养。
解题思路:碱性锌锰电池中正极上MnO₂得电子生成MnO(OH),A项正确。铅酸蓄电池充电时,阳极上PbSO₄失电子生成PbO₂,电极反应为PbSO₄ - 2e⁻ + 2H₂O ══ PbO₂ + 4H⁺ + SO₄²⁻,B项错误。K₃[Fe(CN)₆]溶液滴入FeCl₂溶液中,产生KFe[Fe(CN)₆]蓝色沉淀,C项正确。TiCl₄加入水中发生水解反应生成TiO₂·xH₂O和HCl,D项正确。
6. 日光灯中用到的某种荧光粉的主要成分为 $3W_3(ZX_4)_2 · WY_2$。已知:X、Y、Z 和 W 为原子序数依次增大的前 20 号元素,W 为金属元素。基态 X 原子 s 轨道上的电子数和 p 轨道上的电子数相等,基态 X、Y、Z 原子的未成对电子数之比为 2:1:3。下列说法正确的是 (
A.电负性:X>Y>Z>W
B.原子半径:X<Y<Z<W
C.Y 和 W 的单质都能与水反应生成气体
D.Z 元素最高价氧化物对应的水化物具有强氧化性
C
)A.电负性:X>Y>Z>W
B.原子半径:X<Y<Z<W
C.Y 和 W 的单质都能与水反应生成气体
D.Z 元素最高价氧化物对应的水化物具有强氧化性
答案:
6. 参考答案 C
命题意图:本题以某种荧光粉为载体,借助物质原子结构和元素推断,考查元素周期表和元素周期律的有关内容,体现了“证据推理与模型认知”化学学科核心素养。
解题思路:根据基态X原子s轨道上的电子数与p轨道上的电子数相等,同时结合物质的化学式可知,基态X原子的电子排布式为1s²2s²2p⁴,则X为O。基态O原子的未成对电子数为2,则基态Y、Z原子的未成对电子数分别为1、3,结合原子序数关系Y为F或Na,Z为P。结合化合物中各元素化合价代数和为0可确定W为 +2价,且其原子序数最大,故W为Ca,Y为F。元素电负性F > O > P > Ca,A项错误。原子半径F < O < P < Ca,B项错误。F₂、Ca与水反应分别能够生成O₂和H₂,C项正确。磷元素的最高价氧化物的水化物H₃PO₄不具有强氧化性,D项错误。
命题意图:本题以某种荧光粉为载体,借助物质原子结构和元素推断,考查元素周期表和元素周期律的有关内容,体现了“证据推理与模型认知”化学学科核心素养。
解题思路:根据基态X原子s轨道上的电子数与p轨道上的电子数相等,同时结合物质的化学式可知,基态X原子的电子排布式为1s²2s²2p⁴,则X为O。基态O原子的未成对电子数为2,则基态Y、Z原子的未成对电子数分别为1、3,结合原子序数关系Y为F或Na,Z为P。结合化合物中各元素化合价代数和为0可确定W为 +2价,且其原子序数最大,故W为Ca,Y为F。元素电负性F > O > P > Ca,A项错误。原子半径F < O < P < Ca,B项错误。F₂、Ca与水反应分别能够生成O₂和H₂,C项正确。磷元素的最高价氧化物的水化物H₃PO₄不具有强氧化性,D项错误。
7. 取一定体积的两种试剂进行反应,改变两种试剂的滴加顺序(试剂浓度均为 0.1 mol·L⁻¹),反应现象没有明显差别的是 (

D
)
答案:
7. 参考答案 D
命题意图:本题通过实验操作与现象考查考生对化学反应的认识,体现了“科学探究与创新意识”化学学科核心素养。
解题思路:氨水滴入AgNO₃溶液中,先产生白色沉淀,后来白色沉淀溶解;AgNO₃溶液滴入氨水中,开始一段时间无明显现象,不断滴入AgNO₃溶液,后来开始产生白色沉淀。A项不符合题意。NaOH溶液滴入Al₂(SO₄)₃溶液,先产生白色沉淀,后来白色沉淀溶解;Al₂(SO₄)₃溶液滴入NaOH溶液开始一段时间无明显现象,不断滴入Al₂(SO₄)₃溶液,后来开始产生白色沉淀。B项不符合题意。H₂C₂O₄溶液滴入酸性KMnO₄溶液中,溶液紫色逐渐褪去,并有气泡产生,溶液最终为无色;酸性KMnO₄溶液滴入H₂C₂O₄溶液中,紫色迅速褪去,并有气泡产生,溶液最终为紫色。C项不符合题意。KSCN溶液滴入FeCl₃溶液中,溶液变为红色;FeCl₃溶液滴入KSCN溶液中,溶液同样变为红色。D项符合题意。
命题意图:本题通过实验操作与现象考查考生对化学反应的认识,体现了“科学探究与创新意识”化学学科核心素养。
解题思路:氨水滴入AgNO₃溶液中,先产生白色沉淀,后来白色沉淀溶解;AgNO₃溶液滴入氨水中,开始一段时间无明显现象,不断滴入AgNO₃溶液,后来开始产生白色沉淀。A项不符合题意。NaOH溶液滴入Al₂(SO₄)₃溶液,先产生白色沉淀,后来白色沉淀溶解;Al₂(SO₄)₃溶液滴入NaOH溶液开始一段时间无明显现象,不断滴入Al₂(SO₄)₃溶液,后来开始产生白色沉淀。B项不符合题意。H₂C₂O₄溶液滴入酸性KMnO₄溶液中,溶液紫色逐渐褪去,并有气泡产生,溶液最终为无色;酸性KMnO₄溶液滴入H₂C₂O₄溶液中,紫色迅速褪去,并有气泡产生,溶液最终为紫色。C项不符合题意。KSCN溶液滴入FeCl₃溶液中,溶液变为红色;FeCl₃溶液滴入KSCN溶液中,溶液同样变为红色。D项符合题意。
8. 葡萄糖酸钙是一种重要的补钙剂,工业上以葡萄糖、碳酸钙为原料,在溴化钠溶液中采用间接电氧化反应制备葡萄糖酸钙,其阳极区反应过程如下:
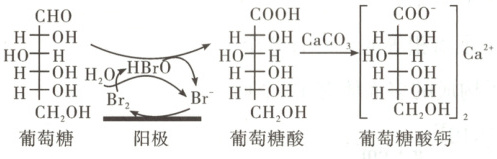
下列说法错误的是 (
A.溴化钠起催化和导电作用
B.每生成 1 mol 葡萄糖酸钙,理论上电路中转移了 2 mol 电子
C.葡萄糖酸能通过分子内反应生成含有六元环状结构的产物
D.葡萄糖能发生氧化、还原、取代、加成和消去反应

下列说法错误的是 (
B
)A.溴化钠起催化和导电作用
B.每生成 1 mol 葡萄糖酸钙,理论上电路中转移了 2 mol 电子
C.葡萄糖酸能通过分子内反应生成含有六元环状结构的产物
D.葡萄糖能发生氧化、还原、取代、加成和消去反应
答案:
8. 参考答案 B
命题意图:本题以葡萄糖酸钙的制备为载体,考查化学反应过程中的原理,意在考查考生的分析推理和读图能力,体现了“宏观辨识与微观探析”化学学科核心素养。
解题思路:据图可知,Br⁻在阳极被氧化为Br₂,Br₂和水反应生成HBrO。HBrO为氧化剂,将葡萄糖转为葡萄糖酸,自身又被还原为Br⁻,故NaBr在反应过程中起催化和导电作用,A项正确。1mol葡萄糖转化为1mol葡萄糖酸,分子中多了1molO,转移2mol电子,而生成1mol葡萄糖酸钙需要2mol葡萄糖酸,故每生成1mol葡萄糖酸钙,理论上电路中转移4mol电子,B项错误。葡萄糖酸分子中含—COOH和—OH,可发生分子内酯化反应形成多种环状结构的产物,其中有六元环状结构的产物,C项正确。葡萄糖分子中含醛基,能发生氧化、还原、加成反应,连有—OH碳原子的邻位碳原子上有H原子,在一定条件下能发生消去反应,D项正确。
命题意图:本题以葡萄糖酸钙的制备为载体,考查化学反应过程中的原理,意在考查考生的分析推理和读图能力,体现了“宏观辨识与微观探析”化学学科核心素养。
解题思路:据图可知,Br⁻在阳极被氧化为Br₂,Br₂和水反应生成HBrO。HBrO为氧化剂,将葡萄糖转为葡萄糖酸,自身又被还原为Br⁻,故NaBr在反应过程中起催化和导电作用,A项正确。1mol葡萄糖转化为1mol葡萄糖酸,分子中多了1molO,转移2mol电子,而生成1mol葡萄糖酸钙需要2mol葡萄糖酸,故每生成1mol葡萄糖酸钙,理论上电路中转移4mol电子,B项错误。葡萄糖酸分子中含—COOH和—OH,可发生分子内酯化反应形成多种环状结构的产物,其中有六元环状结构的产物,C项正确。葡萄糖分子中含醛基,能发生氧化、还原、加成反应,连有—OH碳原子的邻位碳原子上有H原子,在一定条件下能发生消去反应,D项正确。
9. 处理某铜冶金污水(含 $Cu^{2+}$、$Fe^{3+}$、$Zn^{2+}$、$Al^{3+}$)的部分流程如下:
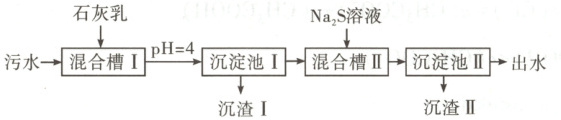
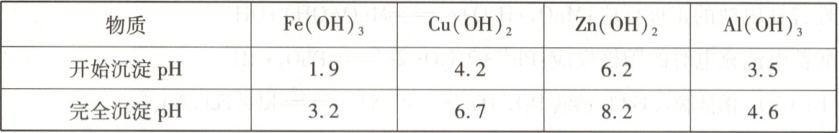
已知:①溶液中金属离子开始沉淀和完全沉淀的 pH 如下表所示:
②$K_{sp}(CuS) = 6.4 × 10^{-36}$,$K_{sp}(ZnS) = 1.6 × 10^{-24}$。
下列说法错误的是 (
A.“沉渣Ⅰ”中含有 $Fe(OH)_3$ 和 $Al(OH)_3$
B.$Na_2S$ 溶液呈碱性,其主要原因是 $S^{2-} + H_2O \rightleftharpoons HS^- + OH^-$
C.“沉淀池Ⅱ”中,当 $Cu^{2+}$ 和 $Zn^{2+}$ 完全沉淀时,溶液中$\frac{c(Cu^{2+})}{c(Zn^{2+})} = 4.0 × 10^{-12}$
D.“出水”经阴离子交换树脂软化处理后,可用作工业冷却循环用水

已知:①溶液中金属离子开始沉淀和完全沉淀的 pH 如下表所示:

②$K_{sp}(CuS) = 6.4 × 10^{-36}$,$K_{sp}(ZnS) = 1.6 × 10^{-24}$。
下列说法错误的是 (
D
)A.“沉渣Ⅰ”中含有 $Fe(OH)_3$ 和 $Al(OH)_3$
B.$Na_2S$ 溶液呈碱性,其主要原因是 $S^{2-} + H_2O \rightleftharpoons HS^- + OH^-$
C.“沉淀池Ⅱ”中,当 $Cu^{2+}$ 和 $Zn^{2+}$ 完全沉淀时,溶液中$\frac{c(Cu^{2+})}{c(Zn^{2+})} = 4.0 × 10^{-12}$
D.“出水”经阴离子交换树脂软化处理后,可用作工业冷却循环用水
答案:
9. 参考答案 D
命题意图:本题以处理铜冶金污水为载体,考查考生对水溶液中离子反应的认识,体现了“宏观辨识与微观探析”化学学科核心素养。
解题思路:结合表中数据可知,pH = 4时,Fe(OH)₃已沉淀完全,Al(OH)₃开始沉淀,则“沉渣I”中含有Fe(OH)₃和Al(OH)₃,A项正确。Na₂S溶液因S²⁻水解而呈碱性,B项正确。“沉淀池II”中,当Cu²⁺和Zn²⁺完全沉淀时,溶液中$\frac{c(Cu^{2+})}{c(Zn^{2+})}=\frac{c(Cu^{2+})c(S^{2 - })}{c(Zn^{2+})c(S^{2 - })}=\frac{K_{sp}(CuS)}{K_{sp}(ZnS)}=\frac{6.4×10^{-36}}{1.6×10^{-24}} = 4.0×10^{-12}$,C项正确。“出水”中除含有阴离子外,还含有大量的Na⁺、Ca²⁺及少量Al³⁺,故经阴离子交换树脂软化处理后,不可用作工业冷却循环用水,D项错误。
命题意图:本题以处理铜冶金污水为载体,考查考生对水溶液中离子反应的认识,体现了“宏观辨识与微观探析”化学学科核心素养。
解题思路:结合表中数据可知,pH = 4时,Fe(OH)₃已沉淀完全,Al(OH)₃开始沉淀,则“沉渣I”中含有Fe(OH)₃和Al(OH)₃,A项正确。Na₂S溶液因S²⁻水解而呈碱性,B项正确。“沉淀池II”中,当Cu²⁺和Zn²⁺完全沉淀时,溶液中$\frac{c(Cu^{2+})}{c(Zn^{2+})}=\frac{c(Cu^{2+})c(S^{2 - })}{c(Zn^{2+})c(S^{2 - })}=\frac{K_{sp}(CuS)}{K_{sp}(ZnS)}=\frac{6.4×10^{-36}}{1.6×10^{-24}} = 4.0×10^{-12}$,C项正确。“出水”中除含有阴离子外,还含有大量的Na⁺、Ca²⁺及少量Al³⁺,故经阴离子交换树脂软化处理后,不可用作工业冷却循环用水,D项错误。
查看更多完整答案,请扫码查看


